
题目列表(包括答案和解析)
9.甲、乙两烧杯中,分别盛放0.5L等物质的量浓度的稀H2SO4,向甲烧杯中加入mgFe粉,向乙烧杯中加入mg Zn粉,完全反应后,发现一烧杯中金属仍有剩余,若稀H2SO4的物质的量浓度为xmol/L,则x的范围应是
A.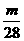 ≥x>
≥x>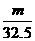 B.
B.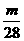 >x≥
>x≥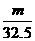
C.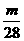 >x>
>x>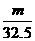 D.
D.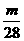 ≥x>
≥x>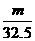
8.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液与原来完全一样的是
A.CuCl2 (CuO) B.NaOH (NaOH)
C.NaCl (HCl) D.CuSO4 (Cu(OH)2)
7.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH = CO2↑+ H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中通入 少量CO2 |
C6H5O-+ CO2
+ H2O → C6H5OH + HCO3- |
错误,通入少量CO2应生成CO32- |
|
C |
NaHCO3的水解 |
HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
正确 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2+
+ 2Br-+ 2Cl2 = 2Fe3+
+ Br2 + 4Cl- |
正确 |
6.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因两者都是正确的是
A.SO2氧化为SO3时采用高压(20MPa-50MPa)的生产条件,来提高SO2的转化率
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用V2O5催化剂,这样可以提高SO2的转化率
D.用98.3%的硫酸吸收SO2,目的是为了防止形成酸雾,以便使SO3吸收完全
5.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
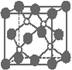 A.磷化硼晶体的化学式为BP,属于离子晶体
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4根共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
4.高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠(离子反应为2Fe(OH)3 +3C1O-+ 4OH-= 2FeO42-+ 3Cl- + 5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
A.高铁酸钠溶解度比高铁酸钾大
B.每生成l mol Na2FeO4,转移3 mol电子
C.高铁酸钾不仅能消毒杀菌,还能除去水中的还原性杂质
D.高铁酸钾溶液是胶体,能吸附水中的悬浮杂质
3.有五组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
① |
He
-268.8 |
(a)
-249.5 |
Ar
-185.8 |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
③ |
(c) 19.4 |
HCl
-84.0 |
HBr
-67.0 |
HI -35.3 |
|
④ |
H2O 100.0 |
H2S -60.2 |
(d)
-42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
C.第④组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
D.上表物质中HF和H2O由于氢键的影响,其分子特别稳定
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
B.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
C.关于反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300 kJ·mol-1,有8NA个碳氧共用电子对形成时,放出1300 kJ的能量
D.在标准状况下,2.24 L的乙烷中含有共价键的数目为0.6NA
1.仅能在水溶液中导电的物质是
A. NaOH B. NaHSO4 C. CH3CH2OH D. NaHCO3
29、将一定质量的铜与140ml一定浓度的硝酸反应,铜完全溶解,产生了NO和NO2的混合气,将此气体与5.04升O2(已换算为标准状况)混合后通入NaOH溶液中全部转化为0.5mol NaNO3。请回答
(1)放入的铜的质量 克
(2)产生的NO的体积 升、NO2的体积 升(均为标准状况)
(3)若向铜完全溶解后的溶液中加入Vml a mol/L 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com