
题目列表(包括答案和解析)
4.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中作用是 ( )
A.酸 B.漂白剂 C.还原剂 D.氧化剂
3.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是 ( )
A.将含有NO2和N2O4分子共约 6.02×1023个的混合气,温度降至标准状况,其体积
约为22.4L
B.7.8g Na2O2与足量水充分反应转移电子数约为6.02×1022个
C.0.05molC5H12分子中所含共价键数约为6.02×1023
D.标准状况下,1mol SiO2晶体中含有共价键数约为2×6.02×1023
2.下列说法不正确的是 ( )
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
C.在101Kpa,1 mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃
烧热
D.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+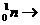 14C+
14C+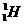 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.14C和14N互为同位素
B.14C和C60是同素异形体
C.14CO2的摩尔质量为46
D.地球上活着的生物体内,由于新陈代射作用也存在14C
例12.科学家对Na2O2结构的认识经历了漫长的过程,最初,科学家提出两种观点:
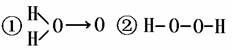
其中①式中氧氧健为配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。化学家Baeyer和Villiyer 为研究H2O2的结构,设计并完成了下列实验:
a. 用(C2H5)2SO4与H2O2反应,生成有机物A和H2SO4。
b. 将生成的A与H2反应(已知该反应中H2作还原剂)。
⑴如果H2O2的结构如①所示,实验b中化学反应方程式为: ;假如H2O2的结构如②所示,则实验b中化学反应方程式为: 。⑵为了进一步确定H2O2的结构,还需在实验b后添加一步实验c,请设计c的实验方案 。
解析:首先考虑a中发生的反应,(C2H5)2SO4 + H2O2 = A + H2SO4 ,根据复分解反应的特点,可推知A的结构为:
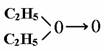
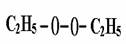
(如果H2O2的结构如①所示); (如果H2O2的结构如②所示);
已知在b反应中H2作还原剂,根据题目所给新信息:在化学反应中氧氧键遇到还原剂时易断裂。可得(1)中所求两个反应方程式分别为:
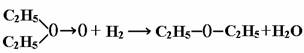
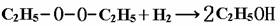
为了进一步确定H2O2的结构是①还是②,可根据(1)中两反应产物的不同来验证,例如:往(1)中反应后的溶液中加入无水CuSO4,若变蓝,则证明H2O2的结构为①式,否则为②式。
这是一个关于H2O2结构的推测、验证的新信息探究题。题目充分体现出化学问题探究的一般过程,培养了学生科学的探究方法,锻炼了学生探究能力。
例10.有一位同学查阅相关资料得知:Na2O2与H2O反应可生成 H2O2。试设计一个简单的实验证明Na2O2与足量H2O充分反应后的溶液中有H2O2存在。可选试剂:Na2SO3、Na2S、FeSO4。
解析:假设反应后的溶液中有H2O2,H2O2有强氧化性,加入Na2S,溶液中会有浅黄色沉淀(S)生成。反之,则证明H2O2不存在。若加入Na2SO3,被氧化为Na2SO4,无明显现象,不能判断;若加入FeSO4,因为溶液为碱液,将发生Fe2+→Fe(OH)2→Fe(OH)3的转化过程,有特殊的实验现象,但是空气中的O2也能产生此转化过程,会干扰对溶液中H2O2的检验。
例11.(1)已知下列反应在一定的条件下可以发生:
H2O2+2Fe2++H+ = 2Fe3++2H2O
H2O2+2Fe3++H+ = 2Fe2++2H++O2↑
在以上反应中Fe2+实际起着 作用,总反应式为 。
(2)I2也与Fe2+一样发生上述类似反应,类比(1)在下面填上合适的化学方程式:H2O2+ I2 = 2HIO, ;总反应式为 。
(3)在H2SO4与KI的混合液中加入足量的,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I- = I2+2H++O2↑这个方程式正确吗? 。若正确,理由是(若认为不正确,则不必作答) 。并写出正确的反应方程式: 。
|
|
|
例8.久置的油画,白色部位(PbSO4)常会变黑(PbO),用双氧水抹擦后又可恢复原貌,有关方程式为 。此时双氧水表现出 。
答案:在此过程中H2O2表现出强氧化性,发生反应PbS + 4H2O2 = PbSO4 + 4H2O 。
例9.为了使鱼苗顺利运输,必须满足三个条件:①保持适量氧气②使鱼苗呼出的二氧化碳及时排出③防止细菌大量繁殖。在长距离运输鱼苗时,最好加入下列哪种物质( )
A.Na2O2 B.氯水 C.CaO2 D.H2O2
答案:C。
例6.在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。填空:在酸性条件下(足量),各取1L浓度为1mol/L的KI溶液分别与上述四种溶液进行完全反应,则需溶质的物质的量之比为n(KIO3) : n(H2O2) : n(FeCl3) : n(K2Cr2O7) = 。
解析:当H2O2遇到还原性物质时表现出氧化性,-1价氧全部变为-2价氧,1molH2O2转化为2molH2O,电子转移为2mol。同理:1mol IO3-转化为0.5molI2,电子转移为5mol;1mol Fe3+转化为1mol Fe2+,电子转移为1mol;1mol Cr2O72-转化为2mol Cr3+,电子转移为6mol。氧化等物质的量的I-,即电子转移的物质的量相同,所以,5n(KIO3) = 2n(H2O2) = n(FeCl3) = 6n(K2Cr2O7),即n(KIO3) : n(H2O2) : n(FeCl3) : n(K2Cr2O7) = 6 : 15 : 30 : 5 。
例7.H2O2溶液滴加了一种含酚酞的NaOH溶液,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个很简单的方案来判断甲乙两位同学的说法是否正确。
解析:若甲同学正确,向红色消失的溶液中继续滴入NaOH溶液,则溶液会又变红。若不变红,则说明不是因为酸碱中和反应使红色消失的,而在于因为H2O2的漂白性使溶液褪色,因为H2O2的漂白原理就是将有机色质氧化为无色物质,不可复原。
答案:向褪色后的溶液中加入NaOH溶液,若变红,甲正确;若不变红,乙正确。
例4.H2O2有还原性可以与硫酸酸化的KMnO4反应。若H2O2中的氧原子为示踪原子(18O),当反应完成后,含有示踪原子的物质是( )
A.O2 B.H2O C.MnSO4 D.K2SO4
解析:H2O2既有氧化性又有还原性,当遇到强氧化性物质时只表现为还原性,其 –1价O全部被氧化为0价O。所以,该反应产物中含18O的只有O2 。答案:A 。
例5.某一反应体系有反应物与生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是 。还原反应过程是 。
(2)如反应转移了0.3mol电子,则产生的气体在标况下的体积为 。
解析:(1)从化合价分析,还原剂只有H2O2 ,发生的还原反应过程是:H2CrO4→Cr(OH)3 (2)因反应中H2O2 只作还原剂,当有1molO2生成时,电子转移为2mol,所以0.3mol电子转移会产生0.15molO2,即3.36L。
例3.已知:经测定H2O2为二元弱酸,其酸性比碳酸弱,它不稳定,易分解成H2O和O2。若向Na2O2中通入干燥的CO2气体,Na2O2与CO2不反应。
(1)写出H2O2在其水溶液中的电离方程式: 。
(2)在一定的条件下,请写出H2O2和Ba(OH)2反应生成正盐的的化学方程式: 。
(3)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程: 。
解析:(1) H2O2≒ H+ + HO2- , HO2- ≒ H+ + O22- 注意:二元弱酸的电离要分步来写,且多元弱酸的第一步电离为主,可以只写第一步的电离方程式也对。如果是纯H2O2液体,同H2O一样能发生自偶电离:2H2O2 ≒ H3O2+ + HO2- 。(2)H2O2 + Ba(OH)2 = BaO2 + 2H2O (3)根据H2O2酸性比碳酸弱,可认为碳酸与Na2O2先生成H2O2:Na2O2 + CO2+ H2O = Na2CO3 + H2O2,再分解:2H2O2 = 2H2O + O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com