
题目列表(包括答案和解析)
11.(9分)含氮废水进入水体而对环境造成的污染越来越严重,某课外兴趣小组先测定某废水中含NO3-为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关反应的离子方程式: NO3-+ Al+ H2O→ N2↑+ Al(OH)3↓+ OH-
(2)上述反应中,还原剂是________,被还原的元素是___________,每生成2molN2,将有_______mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所耗金属铝的质量为_ _____kg。(需要有过程)
10.(6分)已知下列两个热化学方程式:H2(g)+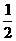 O2(g)=H2O(1); △H=-285.5kJ/mol;
O2(g)=H2O(1); △H=-285.5kJ/mol;
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。写出丙烷燃烧生成CO2和气态水的热化学方程式
9.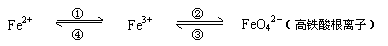 (12分)铁及其化合物的应用十分广泛,亚铁盐、铁盐、高铁酸盐(高铁酸盐只能在强碱性介质中稳定存在)等铁的化合物也在不同的领域中各扮演着重要角色,可用下式表示它们之间的相互转化:
(12分)铁及其化合物的应用十分广泛,亚铁盐、铁盐、高铁酸盐(高铁酸盐只能在强碱性介质中稳定存在)等铁的化合物也在不同的领域中各扮演着重要角色,可用下式表示它们之间的相互转化:
回答下列有关问题:
⑴ Fe与稀硫酸反应可以制取FeSO4,
写出此反应的化学方程式 ,在此反应中,氧化产物是 ;
⑵ 用上述⑴反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净:
要实现①转化可选用的试剂是 , A、Cl2 B、H2O2 C、O3 D、KMnO4
要实现④转化,写出反应的离子方程式 ;
⑶ 在强碱性溶液中,用NaClO可实现②转化,若生成1mol FeO42-,则需NaClO mol;
高铁酸盐是一种“绿色环保高效”消毒剂,比含氯消毒剂的性能更为优良。使用高铁酸盐消毒剂,不仅可以消毒杀菌,还能净水,消毒杀菌时发生的转化是③,净水时发生反应的离子方程式为 。
8. (8分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在石棉 网上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角d 表面皿 e 坩埚钳 f 试管夹
(2)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 ;
(3)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:连续称量的质量相差不超过
为止。
(4)若测定结果x值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热中胆矾晶体溅出 d.胆矾晶体部分风化
7.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为: ⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是( )
A.步骤(1)中MnO2和H2SO4都是氧化剂 B.硫酸在生产中可循环使用
C.步骤(1)中每析出12.8g S沉淀共转移0.8mol电子 D. 电解时MnO2在阳极处产生
6.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液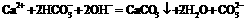
B.氯化铝溶液中加入过量氨水 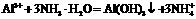
C.0.1mol溴化亚铁中滴入含Cl20.1mol氯水:2Fe2+ +4Br-+ 3Cl2== 2Fe3++2Br2 + 6Cl-
D.浓盐酸跟二氧化锰混合共热 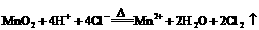
5. 下列各组离子在相应的条件下一定能大量共存的是( )
A.在强碱性溶液中:HCO3-、K+、C1-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在pH=1的溶液中:NH4+、Ca2+、C1-、K+ D.在无色溶液中:Fe3+、C1-、NO3-、A13+
4.下列中学常见实验的现象或表述正确的是( )
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为“蓝色固体”
3.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO –>I2>SO42– B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色 D. 次氯酸钠可以与亚硫酸钠共存
2.一定时间内开始聚沉所需要电解质的浓度(m mol·L-1)称为“聚沉值”。电解质的“聚沉值”越小,则表示其聚沉能力越大。实验表明,聚沉能力主要取决于与胶粒相反电荷的离子所带的电荷数。电荷数越大,聚沉能力越大。则向氢氧化铁胶体中加入下列电解质时,其“聚沉值”最小的是( )
A.NaCl B.AlCl3 C.K2SO4 D.Na3PO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com