
题目列表(包括答案和解析)
9、(14分)下图表示各物质之间的相互转化关系(部分反应物或生成物未列出)。其中A、D为常见金属,J为红褐色沉淀。
(1)A的原子结构示意图为_____________,B的化学式为_______________。
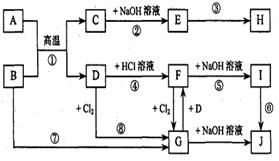 (2)反应②的离子方程式________________
(2)反应②的离子方程式________________
________________,反应⑥的化学方程式
________ ___________________。
(3)在反应③中,要使E中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物
是_______________;若将E溶于过量盐酸,反应的离子方程式为___________________。
(4)在实验室进行反应⑧时,观察到的现象是__________________________________,
在所得产物中加入水,得浑浊液,要使其变澄清,可加入少量的_____________________。
8、经一定时间后,可逆反应aA+bB
 cC中物质的含量A%和C%随温度的变化曲线如
cC中物质的含量A%和C%随温度的变化曲线如
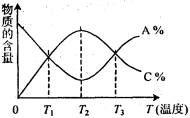 右图所示,下列说法正确的是 ( )
右图所示,下列说法正确的是 ( )
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
7、25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
6、根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是 ( )
|
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质B |
|
熔点 |
810℃ |
710℃ |
190℃ |
-68℃ |
2300℃ |
|
沸点 |
1465℃ |
1418℃ |
183℃ |
57℃ |
2500℃ |
A.SiCl4形成的是分子晶体 B.单质B可能是原子晶体
C.NaCl中键的强度比MgCl2的小 D.不能用电解熔化AlCl3制取单质铝
5、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A、H2 + 2OH- -2e- =2H2O B、O2 + 4H+ + 4e- = 2H2O
C、H2 - 2e-= 2H+ D、O2 + 2H2O + 4e- = 4OH-
4、下表为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
A.非金属性:Y >Z>.M B.气态氢化物的稳定性:Y<M<Z
C.原子半径:M>Z>Y D.ZM2分子中各原子的最外层均满足8e-稳定结构
3、如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X
为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单
质。Z为品红溶液。实验中观察到Z褪色。则Y为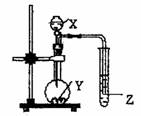
|
X |
|
|
|
Y |
|
|
Z |
M |
|
A.Na B.Mg C.Al D.Mg或Al
2、认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法正确的是
A.镁在空气中或纯净氧气中燃烧的产物一定只有MgO
B.钠在敞口容器中长期存放或在空气中燃烧的产物一定是Na2O2
C.一定条件下,SiO2与焦炭反应,生成的产物一定是单质硅
D.向苯酚钠溶液中通入少量CO2或过量CO2,产物一定含有NaHCO3
1、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
11.(10分)(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物AlN、AlP、AlAs等是人工合成的平等体材料,其晶体结构与单晶硅相似,As原子的电子排布式为 。在AlN晶体中,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间构型为 。在四大晶体类型中,AlN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com