
题目列表(包括答案和解析)
19..0.1mol/L NH3·H2O用水稀释后下列说法不正确的是
①电离程度增大 ②OH-离子数目增多 ③pH值增大 ④导电性增强
A 只有① B 只有② C ③和④ D ①和②
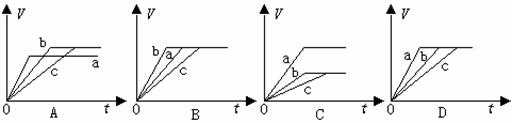
18.等质量的三份铁a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是
17.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,下列说法正确的是( )
CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e- = Li++C6
B.放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
16.下列各组离子,在所给条件下一定能够大量共存的是( )
A.pH=0的溶液中:Fe3+、Mg2+、NO3-、SO42-
B.能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
C.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32-
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl-
15.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH
= CO2↑+ H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中通入 少量CO2 |
C6H5O-+ CO2 + H2O → C6H5OH + HCO3- |
错误,通入少量CO2应生成CO32- |
|
C |
NaHCO3的水解 |
HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
正确 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2+
+ 2Br-+ 2Cl2
= 2Fe3+ + Br2 + 4Cl- |
正确 |
14.类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能决定其正确与否。以下几种类推结论中,不正确的是( )
A.金属镁失火不能用二氧化碳灭火器扑灭;金属钠失火也不能用二氧化碳灭火
B.浓硫酸具有强氧化性,可使铁钝化;浓硝酸也具有强氧化性,也能使铁钝化
C.C在自然界有稳定的单质存在;Si在自然界也有稳定的单质存在
D.Al在O2中燃烧,生成Al2O3,Fe在O2中燃烧生成Fe2O3
13.下列离子方程式正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
2 OH- + NH4+ + HCO3-== CO32-+ NH3·H2O + H2O
B.乙酸和氢氧化钠溶液混合:OH-+ CH3COOH = CH3COO- + H2O
C.次氯酸钠溶液和氯化亚铁溶液混合:
6 Fe2+ + 3 ClO- + 3 H2O == 2 Fe(OH)3↓ + 4 Fe3+ + 3 Cl-
D.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3 H+ = Fe3+ + 3 H2O
12.下列各组比较项目包含的数据关系中,前者比后者大的是( )
A.氨水与氯水中微粒种数 B.NH4+离子与 P4分子中的键角
C.C2H2与 C6H6分子中碳碳键键长 D.H2O2与 O2分子中氧氧键键能
11.下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(l) △H =-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH
溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol-1
D.己知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
10.右图是反应A2 +B2 2AB 在不同温度和压强下,AB体积
2AB 在不同温度和压强下,AB体积
 分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
分数(AB%)的变化情况,其中a、b 曲线为相同压强、不同温
度时的变化情况,c 曲线在保持与b 相同温度时从时间t3 开
始增大压强的情况,则下列叙述正确的是( )
A.A2 、B2 、AB 均为气体,正反应放热
B.AB 为气体,A2 、B2 中最少有一种为非气体,正反应放热
C. AB 为气体,A2 、B2 中只有一种为非气体,正反应吸热
D.从时间t3开始到重新达到平衡这段时间内,体系内的气体平均摩尔质量一定发生变化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com