
题目列表(包括答案和解析)
16.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)浓度(mol·L-1)为 ( )
A (y-2x)/a B (y-x)/a C (2y-2x)/a D (2y-4x)/a
第Ⅱ卷(满分62分)
15.某同学按图所示的装置进行电解实验。下列说法正确的是 ( )
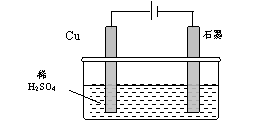 A.电解过程中,铜电极上有H2产生
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:
Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
14.下列叙述错误的是 ( )
A.第ⅦA族的砹化银见光容易分解,难溶于水
B.第ⅥA族的H2O、H2S、H2Se随着相对分子质量的增大,沸点逐渐升高
C.按C、N、O、F的顺序,元素的最高正价依次升高
D.第ⅢA族的氢氧化铊[Tl(OH)3]不一定呈两性
13.已知主族元素A、B、C、D的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-具有相同的电子层结构。则下列叙述正确的是(n为正整数) ( )
A.原子序数:a < b < d < c
B.离子半径:A(n+1)+ > Bn+ > C(n+1)- > Dn-
C.单质的还原性:B > A;单质的氧化性:D > C
D.离子的还原性:A(n+1)+ > Bn+;离子的氧化性:C(n+1)- > Dn-
12.关于下列各装置图的叙述中,正确的是
(
)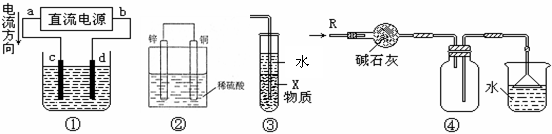

A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
11.下列离子方程式中正确的是 ( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42- = BaSO4↓+2H2O
 B.向漂白粉溶液中通入
B.向漂白粉溶液中通入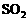 气体:
气体: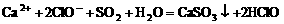
C.用碳棒作电极电解氯化钠饱和溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑
D.氢氧化铁溶解在氢碘酸溶液中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
10. 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
( )
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
( )
A.该硫酸的物质的量浓度为9.2mol/L
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L
9.下列关于某无色溶液中所含离子的鉴别,判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
8.用石墨作电极,电解1mol·L-1下列物质的溶液,溶液的pH值保持不变的是 ( )
A.HCl B.NaOH C.Na2SO4 D.NaCl
7.氯酸(HClO3)是一种强氧化性酸。若将铜投入氯酸溶液中,下列物质一定不可能生成的是 ( )
A.氯酸铜 B.高氯酸铜 C氯化铜 D.氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com