
题目列表(包括答案和解析)
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
28 (10分)下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
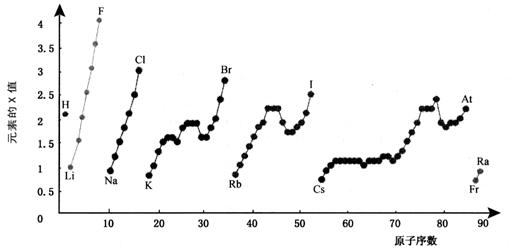
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
29 (10分)下图为周期表中原子体积(单质原子的摩尔体积)随原子序数变化的关系。
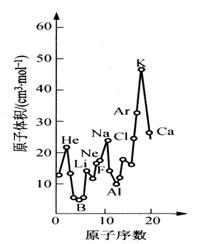
(1)第二周期原子体积最大的元素形成的固态单质属于_________________晶体。第三周期原子体积最小的元素核外电子排布式为_________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有______________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又由小变大
b. 每一周期中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐渐减小
(4)由此可见,在元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律。试写出一条Ⅶ族元素所形成的化合物某种性质的变化规律:
_______________________________________________________________。
27 (8分))根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,D、E常温下为气体,X常温下为无色无味透明液体,H与E相对分子质量之间的关系为:M(H)-M(E)=34,又知C焰色反应火焰呈紫色,J为红褐色沉淀。
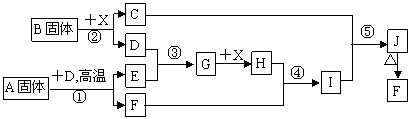
(1)固体B的电子式为 ,其中所包含的化学键有 。
(2)固体A的化学式为 ,其中非金属元素的化合价为 。
(3)反应④的离子方程式 。
反应⑤的化学方程式 。
(4)用铜作电极电解H溶液,阳极的电极反应式是 。
(5)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
24 (9分)[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备[(NH4)2SO4·FeSO4·6H2O]。 实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得[(NH4)2SO4·FeSO4·6H2O]。
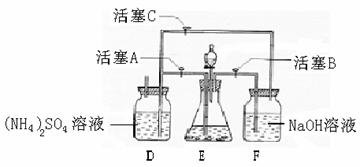
试回答下列问题:
(1)用Fe屑和稀H2SO4反应产生的氢气赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,其目的是 ;操作时应先关闭活塞 ,并同时打开活塞 ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 。
(2)使[(NH4)2SO4·FeSO4·6H2O]结晶的实验操作是:将硫酸亚铁溶液与硫酸铵溶液的混合液转移至蒸发皿中, ,得到[(NH4)2SO4·FeSO4·6H2O]晶体。
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
25 (11分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为______________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ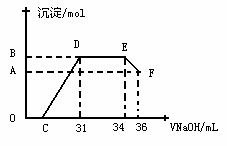 . 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________ _____。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ __;
上述现象说明溶液中 、 、_______结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
26 (12分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 _________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_______________。 实验③:把红色布条放在水里,布条不褪色。 |
________ _________ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3  HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
②氯气和碳酸钠按照1︰1的比例恰好反应_____________________________________;
③将过量的氯气通入到少量的碳酸钠溶液______________________________________。
 21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是 (填写物质的化学式);
②X与甲反应的化学方程式是
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。试推断:
① 甲、乙、丙的化学式。
② 写出X与足量的甲在溶液中完全反应的离子方程式 。
22 (11分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”, 铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
(1)铅位在周期表的 周期 族,已知+2价铅比+4价铅稳定,即+4价铅有较强的氧化性。
将PbO2与浓盐酸加热产生黄绿色的气体,写出该反应的离子方程式 ,
将SO2通入棕色PbO2的悬浊液会产生白色沉淀,写出该反应的化学方程式 。
(2)铅在自然界主要以方铅矿(PbS)存在,铅锭冶炼厂主要采用火法冶炼铅,其主要过程是先煅烧方铅矿制氧化铅,再用CO还原氧化铅制铅。请写出上述过程有关的化学方程式 , 。
(3)铅蓄电池是最常见的二次电池,它的正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是H2SO4溶液。请写出电池放电时总反应式 ,放电过程中电解质溶液H2SO4的浓度将变 (填变大、变小或不变),当外电路通过2mol电子时,理论上负极板的质量增加 g。
(4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的化学式 。近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是 。
23 (11分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是 (填化学式),其原因是
;
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有 ;
(3)E原子的电子排布式为: ;
(4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时
间后, 极(填电极名称)附近出现红色;另一极的电极反应式
为 ,可用 检验该极所得产物。电解的总反应方程式
为 。
20.在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉, 下列说法中不正确的是 ( )
A.若锌粉有剩余, 则不溶物中一定有铜,可能有铁
B.若锌粉有剩余, 则溶液中的金属阳离子只有Zn2+
C.若锌粉无剩余, 且溶液中尚存有Cu2+, 则一定有Fe2+
D.若锌粉无剩余, 且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+
第Ⅱ卷 非选择题(共80分)
19.下列离子方程式正确的是( )
A. 氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42- →BaSO4↓+H2O
B. 饱和碳酸钠溶液通入二氧化碳后溶液浑浊:2Na++CO32-+CO2+H2O → 2 NaHCO3↓
C. 少量SO2用氨水吸收:2NH3·H2O + SO2 → 2NH4+ + SO32- +H2O
D. 往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀:
Al3+ + 2 SO42- + 2 Ba2+ + 3OH - → Al(OH)3↓+ 2BaSO4↓
18.可逆反应A(g)+ B(s)  2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
A. 增大B物质的量 B. 升温 C. 减压 D. 使用适宜催化剂
17.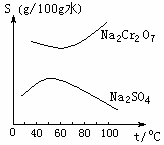 根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。
根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。
这三个操作不包括( )
A. 升温结晶 B. 趁热过滤
C. 降温结晶 D. 蒸发结晶
16.根据有关化学原理,下列判断正确的是( )
A. 常温下,弱酸A的浓度小于弱酸B,则A的电离度一定大于B
B. 晶体A易溶于CCl4,则A一定是分子晶体
C. 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属
D. 能量低的状态更稳定,则自然界的物质都以能量最低的形态存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com