
题目列表(包括答案和解析)
4.已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸变蓝
下列判断正确的是
A.上述实验证明氧化性:MnO4- > Cl2 > Fe3+ > I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
3.将SO2通到显红色的酚酞试液中,发现红色消失,主要是因为SO2( )
A.有漂白性 B.有还原性 C.有氧化性 D.溶于水后显酸性
2.成语包含了透彻完整的思想内容,寓意深刻,生动形象,简练明了,是我国古代历史文化的宝贵遗产。下列有关金属的成语中,与碱金属有关的是( )
A. 百炼成钢 B. 火树银花 C. 点石成金 D. 沙里淘金
1.SO2通入下列溶液中,肯定不会生成沉淀的是( )
A.氯化钡溶液 B.氢氧化钡溶液 C.硫化氢溶液 D.澄清石灰水
27.(12分)在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:
3A(g)+B(g) xC(g)+2D(g),2分钟后当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
xC(g)+2D(g),2分钟后当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,通过计算完成下列问题:
(1)x的值为 ;
(2)平衡时A的转化率为 ;这段时间内用A的的浓度变化表示反应速率为 ;
(3)如果加入0.2mol的C、 0.2molD、0.9molB和0.7molA充入到原来容器内,保持原来的条件不变,则达到平衡时B的物质的量浓度是 。
(4)若在该平衡下,在保持压强不变时,向该容器内充入氦气,则该平衡向 (填“正向移动”“逆向移动”“不移动”);若在该平衡下,在保持容器体积不变时,再向容器中充入2 mol A,达到新平衡时,A的转化率 (填“增大”“减小”“不变”)。
26.(9分)(1) 将pH=3的酸HnA的溶液与pH=11的碱BOH的溶液等体积混合后,溶液呈酸性.由二者生成的盐BnA只有一种离子水解,其水解的离子方程式 是 。
(2) 浓度为0.1mol·L-1的KHCO3和NaAlO2溶液,它们的PH值分别为8和11,则这两种溶液混合时的现象为 ,产生此现象的原因用离子方程式表示为
25.(9分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
24.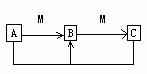 (10分)A、B、C、M有如下图转化关系(部分反应物及生成物略去),其中A、B、C均含有相同元素,所涉及的反应均为中学常见反应。
(10分)A、B、C、M有如下图转化关系(部分反应物及生成物略去),其中A、B、C均含有相同元素,所涉及的反应均为中学常见反应。
(1)下列说法正确的是 (填编号)
①A只可能是单质不可能是化合物
②若A是单质则既可以是金属也可以是非金属
③若A是化合物,则既可以是酸,也可以是碱,还可以是盐
④B只可能是单质不可能是化合物
⑤M只可能是单质不可能是化合物
⑥若M是单质则既可以是金属也可以是非金属
⑦所涉及反应既可能是氧化还原反应,也可能是非氧化还原反应
(2) 从(1)中任选一正确选项并举出实例(只需用化学方程式表示出A+C→B,)
你所选的一项是 (填编号),A+C→B:
。
23.(12分)三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
① 配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
② 每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③ 加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液煮沸约1分钟,冷却至常温;
④ ……………………;
⑤ 重复②③④步操作1-2次;
⑥ 记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: 。
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是 (填代号)
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 。
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液,从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项)。
A.50mL,50mL B. 150mL,100mL C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 。(不需要化简)
22. (6分)普通漏斗(见右图)是中学化学实验室常用仪器之一。
(6分)普通漏斗(见右图)是中学化学实验室常用仪器之一。
我们对它的用途并不陌生。
⑴请举两例说明普通漏斗在化学实验中的运用:
__________________________________________________________________
⑵你是否探讨过在化学实验中创新地使用普通漏斗?请你积极参与到下面的讨论中:
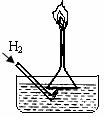
 ①右图1是某同学实验室制备H2并验证H2具有可燃性装置的一部分,请说出他这样做的优点_______
___________。
①右图1是某同学实验室制备H2并验证H2具有可燃性装置的一部分,请说出他这样做的优点_______
___________。
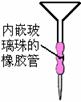
②某同学用苯萃取碘水中碘时,找不到分液漏斗。
他灵机一动,先在试管中将混合液充分振荡后静置,
然后再用普通漏斗和其他常见实验仪器和用品组装
成一个简易分液装置进行分液(右图2),解了燃眉
之急。试分析该设计的不足之处_______________ 图1 图2
_______________________________ ____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com