
题目列表(包括答案和解析)
5.近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的正极反应为4H++O2+4e-=2H2O
4.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
A.加入10mL 0.01mol·L-1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol·L-1的盐酸溶液
3.已知热化学反应方程式:
Zn(s)+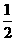 O2(g)=ZnO(s);△H=-351.5kJ·mol-1
O2(g)=ZnO(s);△H=-351.5kJ·mol-1
Hg(l)+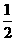 O2(g)=HgO(s);△H=-90.84kJ·mol-1
O2(g)=HgO(s);△H=-90.84kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为
A.△H=+260.7kJ·mol-1 B.△H=-260.7kJ·mol-1
C.△H=-442.3kJ·mol-1 D.△H=+442.3kJ·mol-1
2.下列操作中,能使电离平衡H2O  H++OH-,向右移动且溶液呈酸性的是
H++OH-,向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
1.下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数
B.焓变小于0而熵变大于0的反应肯定是自发的
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
34. (12分) 6.4克铜与过量硝酸(a mol/L ,30mL)充分反应,硝酸的还原产物只有NO2、NO,反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)
33、(12分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
32.(8分)抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4-+□H2O2+□H+===□Mn2++□O2十□H2O
② H2O2+2 +2H+===I2+2H2O
+2H+===I2+2H2O
|
③
+2 +2H+===CH3COOH+I2+H2O
+2H+===CH3COOH+I2+H2O
④ I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
MnO4-+ H2O2+ H+ === Mn2++ O2十 H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是___________________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0
mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成
I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ___________ 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
31.(13分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
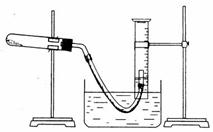
回答下列问题:
(1)如何检查装置的气密性?____________________________________________ 。
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:___________________(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
___________________________________________________________
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= __________________________________________。
|
30.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是饱和溶液 B.t℃时A的溶解度为75 g
C.若A是CuSO4,则7.5 g晶体中含水2.7 g D.原溶液中A的质量分数为40%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com