
题目列表(包括答案和解析)
4、下列取代基或微粒中,碳原子不满足最外层为8电子结构的是
A、一氯甲烷(CH3Cl) B、碳正离子(CH3+)
C、碳负离子(CH3-) D、二氧化碳(CO2)
3、科学家最近发现2种粒子:第1种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子是氧元素的另一种同位素 D、第2种粒子的化学式为O4
2、在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A、CH3OH(l)+ O2(g)
O2(g) CO2(g)+2H2O(l);△H=+725.8 kJ/mol
B、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-1452 kJ/mol
C、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-725.8 kJ/mol
D、2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=+1452 kJ/mol
1、
 下列表达方式错误的是
下列表达方式错误的是
A、氯化氢分子的电子式:H+ [: :]- B、S2-的结构示意图:
C、O-18的原子符号: D、CO2分子的结构式:O=C=O
D、CO2分子的结构式:O=C=O
21.(16分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)= mol·L-1
c(OH-)-c(HA)= mol·L-1
20.(12分)在一个固定容积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) 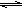 CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b. △H不变
c. v正(H2)=v逆(CO) d.CO的质量分数不变
(3)温度为850℃时,可逆反应:CO(g)+H2O(g) 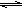 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的浓度(mol·L-1) 变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:0-4min时v(CO)=________mol/(L·min),H2O(g)的转化率= 。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选),表中5min~6min之间数值发生变化,可能的原因是___________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
19.(9分)氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
(1)用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2(g)+3H2(g) 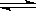 2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
①请写出该反应的热化学方程式 。常温下,将10mol N2和30mol H2放入合成塔中,放出的热量 (填“大于”或“大于”或“小于”)924 kJ
②如果一个反应的△H-T△S<0,则该反应能够自发进行。已知该反应的△S=-198.2J·K-1·mol-1。请判断上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(2)Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传递H这种方法实现了高温常压下高转化率的电化学合成氨。已知阳极发生的电极反应为:H2→2H++2e-。则阴极的电极反应为 。
18.(8分)工艺上制取纯净的CuCl2·2H2O的主要过程是:①将粗CuO(含少量Fe)溶解于稀盐酸中,加热、过滤,调节滤液的pH为3;② 对①所得滤液按下列步骤进行操作:

已知Cu2+、Fe2+在pH为4-5时不水解,而Fe3+却几乎完全水解而沉淀。
回答下列问题:
(1)X是 (填写化学式),其反应的离子方程式是 。
(2)生产中Y可选用 (填写化学式),其目的是
。
(3)溶液乙在蒸发结晶过程中必须采取的措施是
。
17.(7分)(1)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边画出能够实现这一反应的实验装置图。
(2) 某同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒缺没有被腐蚀。请你分析其原因 ,
此时的电池反应为 。
16.在2L的密闭容器中把4molA和2molB
混合,在一定条件下发生反应3A(g)+2B(g) 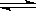 zC(g)+2D(g)。2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2
mol·L-1·min-1,下列说法正确的是
zC(g)+2D(g)。2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2
mol·L-1·min-1,下列说法正确的是
A.z=4 B.B的转化率是20%
C.A的平衡浓度是1.6mol·L-1 D.平衡时气体压强是原来的0.94倍
08届高三化学第一次调研考试试题
化 学
第Ⅱ卷(非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com