
题目列表(包括答案和解析)
5.具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是 ( )
A.原子半径:X>Y>Z B.元素的非金属性:X>Y>Z
C.气态氢化物的稳定性:X<Y<Z D.阴离子的还原性:X>Y>Z
4.橙花醛是一种香料,其结构简式为:(CH3)2C-CHCH2CH2C(CH3)-CHCHO。下列说法正确的是 ( )
A.橙花醛不能与Br2发生加成反应
B.橙花醛能发生银镜反应
C.1 mol橙花醛最多可以与2 mol H2发生加成反应
D.橙花醛是乙烯同系物
3.高压电机、复印机工作时会产生臭氧,该气体具有强氧化性。下列叙述中不正确的是( )
A.臭氧和氧气是氧的同素异形体
B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害
D.臭氧是很好的消毒剂和脱色剂
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下开与这些用途无关的性质是 ( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
1.汽车排放的尾气中因含有氦的氧化物而污染大气,造成产生氦的氧化物的主要原因是
( )
A.燃烧含氦化合物燃料 B.燃烧含铅汽油
C.由于燃烧不充分 D.在气缸中N2被氧化
①称取2gCuSO4·5H2O研细后倒入烧杯,加10mL蒸馏水溶解
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤、晾干后研细备用。回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验序号),步骤①、③中研磨固体所用仪器的名称是 ;
(2)步骤③中洗涤沉淀的操作是
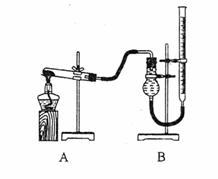 (二)证明氧化铜能加快氯酸钾的分角并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
(二)证明氧化铜能加快氯酸钾的分角并与二氧化锰的催化效果进行比较用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
KC1O3质量 |
其它物质质量 |
待测数据 |
|
④ |
1.2g |
无其他物质 |
|
|
⑤ |
1.2g |
CuO 0.5g |
|
|
⑥ |
1.2g |
MnO2 0.5g |
|
回答下列问题:
(3)上述实验中的“待测数据”指 ;
(4)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,
(5)为探究CuO的实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a. ;
b.CuO的化学性质有没有改变。
12.(16分)已知物质A显酸性,F为七原子组成的环状物,请根据以下框图回答问题:
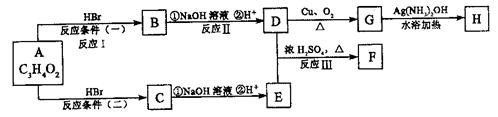
(1)写出下列物质的结构简式:A: ,
G: 。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为 、 、 。
(3)写出D和E反应生成F的化学方程式: 。
(4)写出C的同分异构体属于酯类物质的结构简式:(任写两种) 、 。
24.为测定某氧化物(化学式为MO)中M是何种金属,做以下实验:称取该氧化物8.0g溶于适量的稀H2SO4中,再配制成250.0mL溶液。取该溶液50mL,用惰性电极进行电解,当刚好电解完时,电极上析出M1.28g.请通过计算回答下列问题:
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)若此电解液在电解后体积为40mL,此溶液的pH为多少?
23.(8分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
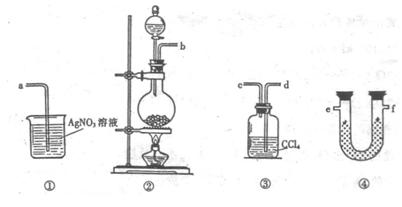
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
 b接 , 接
, 接a。
b接 , 接
, 接a。
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性,证
明最终通入AgNO3 溶液的气体只有一种,乙同学提出在
某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
22.(8分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3.Cu(NO3)2.AgNO3。(加热及夹持装置未画出)
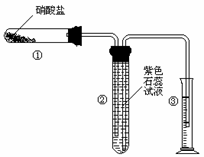
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程式: 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
 (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
20.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
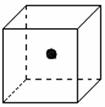 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4 (g) + 2H2(g) Si(s) +
4HCl(g)
SiCl4 (g) + 2H2(g) Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
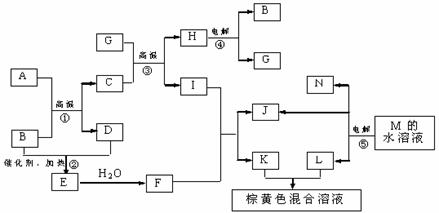 21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com