
题目列表(包括答案和解析)
29、A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为____;
(2)B元素的负一价离子的电子层结构与氩相同,C元素的正一价离子的电子层结构与氙相同,B、C形成的化合物的化学式为 ;其晶体内每个B离子周围有 个C离子与之紧相邻。其晶体的主要物理性质有: _(写出两条即可)。
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其单质在一定条件下能与硫(S)反应,试写出该反应方程式 _______________________。
28、(10分)奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
⑴A的分子式为___________。
已知:
A中含有碳氧双键,与A相关的反应如下:

⑵写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
⑶写出A、C、F的结构简式:A _____________、C ____________、F ___________。
⑷写出B → D反应的化学方程式:_________________________________________。
⑸在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式:________________。A → G的反应类型为_________。
27.(10分)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是 。
(2)A有2个不同的含氧官能团,其官能团名称是 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:
、 。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是
。
26、(10分)铁及铁的化合物应用广泛,如FeCl3可作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池装置图,标出正、负极,并写出电极反应式。
正极反应
负极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
25、(12分)在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰.通过_______________________
 (填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①
与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①
与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是: _______________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________________________ |
|
然后溶液从无色逐渐变为____色 |
_______________________________________________ |
24、(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
23.(9分)利用右图装置测定中和热的实验步骤如下:


① 用量筒量取50moL 0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度为25.0℃
② 用另一量筒量取50mL 0.55mol·L-1 NaOH溶液,并用另一温度计测出其温度为25.2℃
③ 将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度为28.5℃。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? ;
(2)倒入NaOH溶液的正确操作是 .(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 (从下列选出)
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻的搅动
(4)设溶液的的密度均为1g·cm-3,中和后溶液的比热容C=4.18 J·(g·℃)-1,请根据该反应中和热的实验值写出中和反应热化学方程式 ;
(5)上述实验中中和热的实验值往往小于理论值,其主要原因是(设操作无误)
,请提出改进措施 。
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是______ _______________ ________ 。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___。
 实验二、定量研究:
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现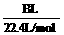 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是________ ________ 。
22.(11分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为______________。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。量取时发现量筒不
干净,用水洗净后直接量取,所配溶液浓度将_________(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的_______里,并不断搅拌,目的
是__________________________________________。
(4)将__________________的上述溶液沿______________注入___________________中,并用
50mL蒸馏水洗涤烧杯2-3次,洗涤液要_______________________中,并摇匀。
(5)加水至距刻度___________时,改用______________加水,使溶液的凹液面正好跟刻度相平。
21.(10分)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
20、a、b、c、d、e均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO32- SO42- HSO-4 |
分别取它们的水溶液进行实验。结果如下:
①a溶液与b溶液反应生成白色沉淀,沉淀可溶于e溶液;
②a溶液与c溶液反应生成白色沉淀,沉淀可溶于e溶液;
③a溶液与d溶液反应生成白色沉淀,沉淀可溶于盐酸;
④b溶液与适量d溶液反应生成白色沉淀,加入过量d溶液,沉淀量减少,但不消失。据此推断
A.e中一定含有HSO4-
B.a中一定含有Al3+
C.d中一定有OH-
D.c中可能含有CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com