
题目列表(包括答案和解析)
23.(14分)
(1)_________ 。
2)__________ 。
______ 。
(3)_____ __。
(4)(用文字说明)________________ ______。
___________________ ____________。
(5)___________________ ____________。
______________________ _______________。
24(13分)
1)_____晶体,F的化学式(分子式)是________。
(2)____ _____。
(3)____ ____,
_ _______。
22.(14分)
(1) → → → → → → → (填各接口的编号)。
(2) 。
(3) 。
(4) 。
(5) (填“增大”“不变”或“减小”)。
(6),SO2的转化率为 。
21.(10分)(1)________________;(2)___________________;
(3)________________;(4)_________;(5)_______________。
27.(14分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
|
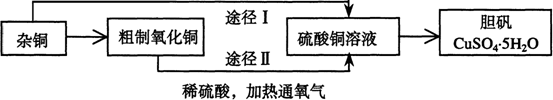
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角
d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 ___________次。
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
 化学答题卷
化学答题卷
第Ⅱ卷 非选择题(共80分)
选择题(共70分)
26.(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3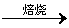 ;
;
Al2O3+Na2CO3 。
。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾ Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是
并写出有关的离子方程式
25.(5分) 有X、Y、Z三种元素:
(a)X、Y、Z的单质在常温下均为气体;
(b)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
(c)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
(d)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
(e)Z单质溶于X2Y中,所得溶液具有漂白性。
(1)试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:
XZ_______,X2Y_________。
24.((13分)下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
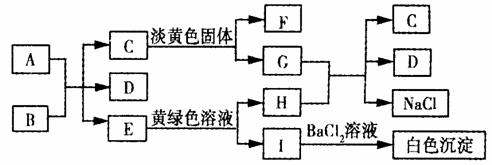
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是:____ _____。
(3)G与H反应的离子方程式是____ ____,
E转变为H和I的离子方程式是_ _______。
23.(14分)下面是关于硫化氢的部分文献资料
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度约为0.1mol·L-1。硫化氢剧毒,经粘膜吸收后危害中枢神经系统和呼吸系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸发生的反应主要有:
2H2S+O2=2H2O+2S↓ 2H2S+3O2=2H2O+2SO2
2H2S+SO2=2H2O+3S↓ 2H2S+Cl2=2HCl+S↓
H2S H2+S↓
H2S+CuSO4=CuS↓+H2SO4
H2+S↓
H2S+CuSO4=CuS↓+H2SO4
H2S+2NaOH=Na2S+2H2O H2S+NaOH=NaHS+H2O
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
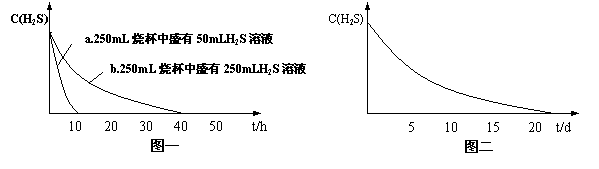
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
 实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象。
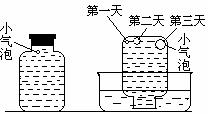
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_________ 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为__________ 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应______
_______ 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____ __的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)________________ ______。此实验中通入空气的速度很慢的主要原因是什么?___________________ ____________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是____ _____。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?______________________ _______________。
22.(14分)实验室制取SO2的反应原理为:
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
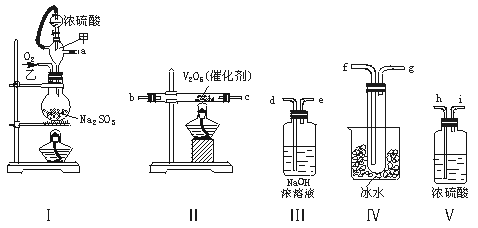
(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
21.(10分)硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
(1)实验室制取氢气________________;
(2)实验室干燥氢气___________________;
(3)浓硫酸与金属铜的反应________________; (4)实际生产中,浓硫酸可用钢瓶贮运_________;
(5)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com