
题目列表(包括答案和解析)
19.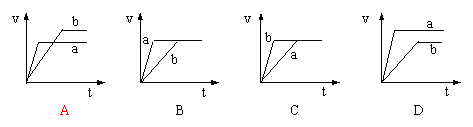 将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是
将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是
18.已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和lmolO2,且发生反应为2SO2(g)+O2(g) 2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A.向甲容器中再充入一定量的氦气 B.向乙容器中再充入2mol的SO3气体
C.适当降低乙容器的温度 D.缩小甲容器的体积
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:
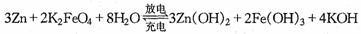
下列叙述不正确的是
A、放电时负极反应式为:Zn-2eˉ+2OHˉ=Zn(OH)2
B、放电时每转移3mol电子,正极有1 mol K2FeO4被氧化
C、充电时阳极反应式为:Fe(OH)3 - 3e-+5OHˉ=FeO42ˉ+4H2O
D、放电时正极附近溶液的碱性增强
16.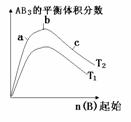 某化学科研小组研究其他条件不变时,改变某一条件对A2(g)+3B2(g)
某化学科研小组研究其他条件不变时,改变某一条件对A2(g)+3B2(g)
 2AB3(g)化学平衡状态的影响,得到如下图的变化规律(图中T表示温度,n表示物质的量),根据如图所示可以得出的结论正确的是:
2AB3(g)化学平衡状态的影响,得到如下图的变化规律(图中T表示温度,n表示物质的量),根据如图所示可以得出的结论正确的是:
A、正反应一定是放热反应
B、达到平衡时,A2的转化率大小为b>a>c
C、正反应一定是吸热反应,且T2>T1
D、b点时,平衡体系中A、B原子个数比接近1:3
15.下列离子方程式中,正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液
Mg2++2HCO3-+4OH- Mg(OH)2↓+2CO32-+2H2O
B.向Fe(NO3)2溶液中加入稀的氢碘酸:3Fe2++4H++NO3- 3Fe3++NO↑+2H2O
C.足量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O 2HCO3-
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全
2Ba2++4OH-+Al3++2SO42- 2BaSO4↓+AlO2-+2H2O
14.矿石中金的含量很低,其性质又相当稳定,只能用湿法冶金一氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金矿石浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au + 8NaCN + O2 + 2H2O = 4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2] + Zn = 2Au + Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是
A.Na[Au(CN)2]属于复盐
B.化合物Na[Au(CN)2]中金元素的化合价为+1
C.金元素在地壳中能以游离态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
13.一定能在下列溶液中大量共存的离子组是
A、使紫色石蕊试液变蓝的溶液:Na+ AlO2- S2ˉ SO42ˉ
B、pH=0的溶液:Zn2+ NO3- Cl- I-
C、由水电离的c(H+)=10ˉ14 mol/ L-l的溶液中:Ba2+ K+ Na+ HCO3-
D、含有大量Al3+的溶液:H+ Cu2+ Mg2+ SO42-
12.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的
A.分子数和气体质量均不同 B.分子数和电子数均相同
C.质子数和中子数均相同 D.分子数、原子数和中子数均相同
11.在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.盐酸和硝酸中放出的氢气量相等
10.有下列五个化学方程式(X、Y、Z均为正值):
 ①C(s)+H2(g)
①C(s)+H2(g)
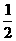 C2H4(g); △H=Z kJ·mol-1
C2H4(g); △H=Z kJ·mol-1
 ②C(s)+
②C(s)+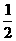 H2(g)
H2(g) 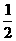 C2H2(g);△H=Y kJ·mol-1
C2H2(g);△H=Y kJ·mol-1
 ③C(s)+2H2(g) CH4(g); △H=X kJ·mol-1
③C(s)+2H2(g) CH4(g); △H=X kJ·mol-1
 ④C2H2(g)+H2(g) C2H4(g)
④C2H2(g)+H2(g) C2H4(g)
|
 ⑤CH4(g) H2(g)+
⑤CH4(g) H2(g)+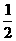 C2H4(g)
C2H4(g)
当温度下降时④式平衡向右移动,⑤式平衡向左移动。据此判定①-③式中关于X、Y、Z的大小顺序排列正确的是
A.X<y<Z B.Z<X<Y C.Y<X<Z D.X<Z<Y
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com