
题目列表(包括答案和解析)
23.根据元素周期表判断,下列叙述中正确的是( )
A.第三周期元素形成的阳离子半径从左到右逐渐减小
B.所含元素种类超过18种的周期是四、五、六、七周期
C.ⅦA族元素的氢化物中,稳定性最好的其沸点也最高
D.周期表中最活泼的非金属元素位于第15纵行,最高价氧化物对应水化物酸性最强的非金属元素位于第17纵行
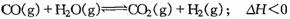 24.在容积不变的密闭容器中存在如下反应:
24.在容积不变的密闭容器中存在如下反应:
对下述图像的描述正确的事( )
A、图像Ⅰt0时刻增大了容器的压强 B、图像Ⅰt0时刻向容器内充入了CO气体
C、图像Ⅱt0时刻增大了容器的压强 D、图像Ⅲ中,甲容器的温度高于乙容器的温度
22、X、Y均为短周期元素,且X为ⅠA族元素,Y为ⅥA族元素。下列说法正确的是 A.X的原子半径一定大于Y的原子半径 B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构 C.X2Y既可能是离子化合物,也可能是共价化合物 D.由X、Y组成的化合物中,X、Y的原子个数比可能是1∶1
21.由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法不正确的是 ( ) A.元素A与B处于同一周期 B.A3+与B2-最外电子层上的电子数相等
C.B是3周期第ⅥA族的元素 D.A2B3是A12O3
20、X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一,下列有关判断中,正确的是 ( )
A.X元素在周期表中的位置只能是第二周期第ⅣA族
B.若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,说明非金属性X比Y强
C.若X能形成XO32-、XO42-,Y能形成YO3-和YO4-,则X、Y一定在同一周期
D.若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少
19、下列实验操作或结论正确的是( ) A.测定硫酸铜晶体中结晶水含量时,须用小火缓慢加热,同时用玻璃棒轻轻搅拌晶
体,防止晶体飞溅 B.配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先放入烧杯中,然后加水稀释
C.配制100g 10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中 D.配制一定物质的量浓度的溶液,定容时必须使溶液的凹液面的最低点与刻度相平,
若俯视定容会使所得溶液浓度偏高
18、某温度下,体积一定的密闭容器中进行如下可逆反应:
 X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
X(g)+Y(g) Z(g)+W(s);△H<0下列叙述正确的是 ( )
A.增加少量W,正反应速率减小 B. 当容器中气体的密度不变时,反应达到平衡
C.降低温度 ,平衡正向移动 D.平衡后加入Z ,上述反应的△H减小
17.从下列事实所列出的相应结论正确的是
|
|
实
验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
结合H+的能力:CO32-< AlO2- |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
16.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.表示CO燃烧热的热化学方程式: CO(g)+1/2O2(g)=CO2(g);△H = -283 kJ/mol
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: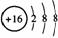 ,NH4Cl的电子式为:
,NH4Cl的电子式为: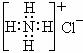
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
15. 铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他们设计了如下方案: (1)铁片置于硫酸铜溶液中有铜析出
(2)铁、铜和氯气反应分别生成FeCl3和CuCl2
(3)足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4
(4)铜片置于FeCl3溶液中铜片逐渐溶解
(5)把铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片上无气泡产生,而铜片上有气泡产生。
(6)把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。 以上设计合理的有 ( )
A、两种方案 B、三种方案 C、四种方案 D、五种方案
14、下列说法:①质子数相同的粒子一定属于同种元素; ②电子数相同的粒子不一定是同一种元素; ③一种元素只能有一种质量数; ④某种元素的相对原子质量取整数,就是其质量数。⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;⑥同位素的性质几乎完全相同;
其中不正确的是( ) A.①③④⑥ B.①②④⑤ C.②③⑤⑥ D. ②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com