
题目列表(包括答案和解析)
5. 下列物质不能与二氧化硫气体反应的是( )
A.品红溶液 B.氯水 C.浓硫酸 D.碱石灰
4. 向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是( )
A.碳酸氢钠溶液中滴加稀硝酸 B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘水中滴加淀粉碘化钾溶液 D.高锰酸钾溶液中滴加亚硫酸钠溶液
3. 25℃时将稀氨水逐滴加入到稀盐酸中,当溶液的pH=7时,c(NH4+)与c(Cl-)大小关系正确的是( )
A . c(NH4+)=c(Cl-) B. c(NH4+)>c(Cl-)
C. c(NH4+)<c(Cl-) D. 无法确定
2. 材料是社会进步的标志,下列物质不属于有机合成材料的是( )
A. 塑料 B. 合成纤维 C. 玻璃 D. 合成橡胶
1. 最近我国科学家开发出第五形态的固态碳,外形类似海绵,并具有磁性,这种固体碳与金刚石的关系是( )
A. 同系物 B. 同位素 C.同分异构体 D.同素异形
 21A .《 物质结构与性质
》( 12 分)
21A .《 物质结构与性质
》( 12 分)
铜合金是人类使用最早的金属材料。铜在化合物中的常见化合价有+ l 、 + 2 等,故能形成多种铜的化合物。
( l )基态 Cu 原子的电子排布式是 ;
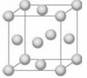
铜晶体晶胞如图所示,该晶胞实际拥有 个铜原子;
( 2 ) ①
某+ l 价铜的配离子为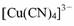 ,与配体互为等电子体的一种微粒是
,与配体互为等电子体的一种微粒是
(写化学式)。
②许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH= CH 2等), CH3CH= CH 2分子中c 子采取的杂化方式有
( 3 )在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式: ;
根据价层电子对互斥模型,预测SO42一的空间构型为
21B . ( (实验化学) ) ( 12 分)氢氧化钠固体常因吸收空气中的二氧化碳而变质。某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠含量,设计了多种实验方案,请结合以下方案回答有关问题:
方案一:称取一定量的氢氧化钠样品mlg ,加水溶解后,逐滴加入沉淀剂至不再产生沉淀为止。将沉淀过滤、洗涤、烘干、称量,质量为 m : g 。沉淀剂使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
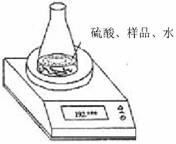 方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案二:利用右图装置测定氢氧化钠样品中 Na2CO3的含量。计算Na2CO3质量分数时,必需的数据是
方案三:操作流程如下:
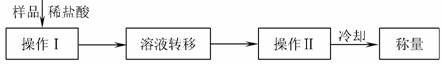
需直接测定的数据是 ;在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
20. ( 7
分)臭氧可用于净化空气,漂白饮用水,杀菌,处理工业废物和作为漂白剂。但臭氧能刺激粘液膜,空气中臭氧的体积分数超过0.1 PPm ( PPm 表示百力分之一)对人体是不安全的。臭氧能与碘化钾溶液反应: 为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为:
为测定大气中臭氧的含量,进行如下操作: ①
将标准状况下 33 . 6L的空气试样缓缓通入KI溶液,使之完全反应; ②在所得溶液中用 0 . 01 mol / L 的 Na2S2O3溶液 60 . 00mL 恰好与之完全反应。(反应方程式为: 设反应过程中溶液的体积变化忽略不 计)
设反应过程中溶液的体积变化忽略不 计)
( l )试通过计算说明该空气试样中臭氧的体积分数对人体是否安全?
( 2 )取步骤 ① 所得溶液的1 / 50 ,欲将其中所含 KOH 完全中和,需 0 . 0012 mol / L 的盐酸体积是多少毫升?
原题:超细硅酸铝具有极好的悬浮性和纯白外观,与颜料配合能明显地改进涂料的白度。其样品化学式可表示为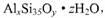 企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 .
936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
企业标准规定超细硅酸铝中含水量7%一10%为优良级。某化学兴趣小组为测定该样品的组成,按如下步骤处理:步骤一:准确称取 9 . 936g 超细硅酸铝样品,充分加热至不再分解为止,冷却、称量,得固体9.216g 。步骤二:另准确称取 9 .
936g 超细硅酸铝样品,加足量 4 mol / L 盐酸 150 mL ,充分反应后,过滤,洗涤,烘干得SiO2固体 8 . 400g
( l )计算该超细硅酸铝样品是否为优良级。
( 2 )求该样品的化学式。
11.梭酸梭基中轻基被氯原子取代的衍生物叫做酞氯。酞氯可以与醇反应生成醋,例如:
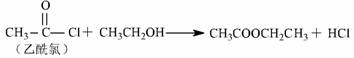
试回答下列问题:
( l )上述转化( ① 一 ⑤ )中,属于取代反应的有 (填序号,下同);属于氧化反应的有 ;属于加成反应的有 ( 2 )试剂 A 的结构简式为

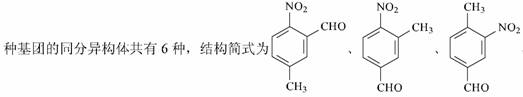
、 、 、
( 4 )写出下列化学方程式
反应⑤
中间体 B 在盐酸作用下发生水解
19. ( 13 分)氯霉素及其衍生物氯霉素棕桐酸酯是广普抑菌抗生素。成氯霉素及其衍生物氯霉素棕桐酸酯的合成路径。
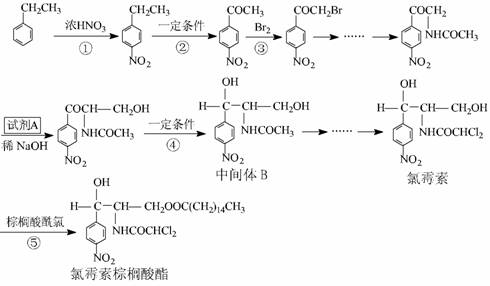
已知: 1 .在稀碱催化下,一些含羰基的化合物能发生如下反应:

18. ( 8 分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
( l )有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
( 2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
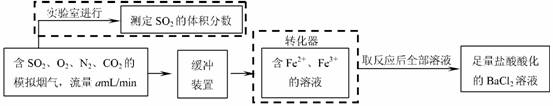
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X 溶液可以是
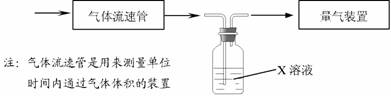
A.碘的淀粉溶液 B . 酸性高锰酸钾溶液C .氢氧化钠溶液 D .氯化钡溶液
② 若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com