
题目列表(包括答案和解析)
10.取500mLNa2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3 : 2 。则碳酸钠溶液的物质的量浓度为 ( )
A.0.2mol/L B.0.3mol/L C.0.4mol/L D.0.5mol/L
9.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2进行喷泉实验,经充分反应后,瓶内溶液中溶质的量浓度为 ( )
A.①>② B.①<② C.①=② D.不能确定
5.下列除去杂质的方法正确的是 ( )
A.氯化钠溶液中混有少量硫酸钠,加适量硝酸钡溶液,过滤后取滤液
B.氢氧化镁中含有氢氧化钙,加入足量氯化镁溶液后过滤后,取滤渣
C.乙浣气体中混有少量乙烯,通入酸性高锰酸钾溶液后,收集气体
D.二氧化碳气体中混有少量二氧化硫,通入饱和碳酸钠溶液后,收集气体
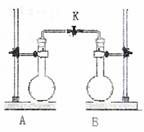 8.如下图,在室温,A、B两个体积相等的烧瓶中分别集满了两种气体(同温同压),当打开活塞K使两瓶内气体充分接触后,容器内压强大小关系是 ( )
8.如下图,在室温,A、B两个体积相等的烧瓶中分别集满了两种气体(同温同压),当打开活塞K使两瓶内气体充分接触后,容器内压强大小关系是 ( )
|
编号 |
① |
② |
③ |
④ |
||
|
A中气体 |
|
NO |
H2S |
NH3 |
||
|
B中气体 |
O2 |
O2 |
SO2 |
HCl |
A.②<③=①<④ B.③<①<④<②
C.④<③<②<① D.④<①=②=③
6.下列各组物质的溶液逐滴互滴,前一种溶液逐滴滴入后一种溶液中,与后一种溶液逐滴滴入前一种溶液中产生的现象相同的是 ( )
①Ba(OH)2和稀H3PO4 ②HNO3和NaAlO2 ③NaOH和AlCl3
④Ca(HCO3)2和Ba(OH)2 ⑤Na2CO3和HCl ⑥AgNO3和NH3·H2O
⑦NaHCO3和HCl
A.①⑤ B.②④ C.⑤⑦ D.④⑦
5.将下列各组气体分别通入水中,其中一种气体消失,另一种气体体积增大的是 ( )
A.CO2和HCl B.O2和F2
C.SO2和Cl2 D.NO2和O2
4.膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之,其分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A.PH3是非极性分子 B.PH3分子中末成键的电子对
C.PH3是一种强氧化剂 D.PH3分子中的P-H键是非极性键
3.下列变化一定不可逆的是 ( )
A.溶解 B.水解 C.电解 D.分解
2.据报道,德国INTEGRAL公司因研究出无辐射冷却技术(用水和冰组成的两相液体代替传统的氟里昂或氨)而荣获该年度德国环境大奖。关于“新制冷剂”的叙述错误的是
( )
A.该制冷剂对环境不产生任何污染
B.该制冷剂的作用原理与氨基本相同
C.该制冷剂在水的凝固点附近的温度下发挥作用
D.该制冷剂是属于悬浊液的一种分散系
1.有一种被称为“生命的花朵”的元素R,在人体内有重要的作用。已知R元素的原子有四个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为 ( )
A.硫 B.砷 C.硒 D.硅
27.(12分)根据右图所提供的信息,在反应一段时间后:
(1)甲池中的现象为:
(2)甲池中总反应的离子方程式为 。
(3)乙池中总反应的离子方程式为 。
(4)将湿润的淀粉KI试纸放在乙池碳棒附近,发现试纸变蓝,其原因是(用离子方程式表示) ;但过一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5 :1,且生成两种酸,该反应的化学方程式为:
。
(5)若乙池的电源连接方向开始时就与上述的图示相反,则反应一段时间后,其溶液中可能出现的现象是
。
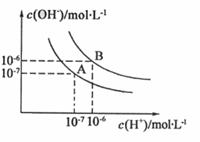 28.(8分)水的电离平衡曲线如右图所示:
28.(8分)水的电离平衡曲线如右图所示:
(1)若以A点表示25℃时水电离平衡时离子的浓度,
当温度升高到100℃时,水的电离平衡状态变到
B点,则此时水的离子积从 变到
,造成水的离子积变化的原因是
。
(2)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为 。
(3)25℃时,将pH = 11的NaOH溶液与pH = 4的硫酸溶液混合,若所得混合溶液pH = 9,则NaOH溶液与硫酸溶液的体积比为 。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com