
题目列表(包括答案和解析)
3.阿伏加德罗常数约为6.02×1023 mol-1,下列说法不正确的是
A.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
B.6.2g白磷P4中所含的P-P键的个数为0.3 NA
C.在标准状况下,V L CH2O中含有的氧原子个数为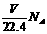
D.1L 0.5 mol/L CH3COONa溶液中含有的CH3COO-个数为0.5 NA
2.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.加强工业用水净化系统工程的改造,提高水的重复利用率
1.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……① Sb4O6+6C=4Sb+6CO ………②
关于反应①、反应②的说法正确的是
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6 B.反应②说明高温下Sb的还原性比C强
C.反应①中每生成3 mol FeS时,共转移6 mol电子
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
25. (本题共8分) 当m mol Na2O2与NaHCO3的混合物在密闭容器中加热至250°C,使其充分反应,混合物中Na2O2的物质的量分数为x
(1)当x= 1/2 时,容器中固体产物是(写化学式) ,其物质的量为
(2)若反应后生成气体是O2和H2O,则x的取值范围________________________ _。
(3)若0<x< 1/3 时,产生气体的物质的量n= mol(用m、x表示)
24.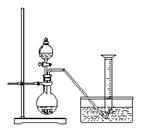 (本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。
(本题共11分) 某同学设计了如下方案,来测定过氧化钠样品的纯度(杂质不参加反应,条件为标准状况)。
实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑
通过测定生成的氧气的体积,经计算可确定样品中过氧化钠的含量。
实验步骤:
①称取过氧化钠样品2.00 g ;
②把这些过氧化钠样品放入气密性良好的气体发生装置中;
③向过氧化钠样品中滴入水,用量筒排水集气,量筒内液面在110 mL处恰与水槽内液面相平;
④ 作为反应器的烧瓶中有54.0 mL液体;
⑤ 将烧瓶内的液体转移到250 mL的容量瓶内,并加水定容。
请回答下列问题:
(1)有1000 mL、 500 mL 、250 mL的量筒备用,则应选用 mL的量筒。
(2)生成气体体积是 mL, 为保证生成气体体积的准确性.读取量筒刻度时应注意的问题是 。
(3)据研究,与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2,H2O2的生成会使测定结果 (填“偏高”或“偏低”)。
(4)为校正实验结果,该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体,放入锥形瓶中,用0.0100 mol/L的KMnO4溶液去测定,至溶液中刚好出现浅浅的紫红色,停止滴定,用去了24.00 mLKMnO4溶液。配平化学反应式方程式:
KMnO4 + H2O2 + H2SO4 -- K2SO4 + MnSO4 + O2↑ + H2O
该实验应选用 式滴定管。
(5)通过以上数据计算,该过氧化钠的纯度为 。
(6)如何避免因为生成H2O2造成的误差? 。
23.(本题共8分) 已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
22.(本题共8分) 科学家用NaNO3和Na2O在一定条件下化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 A 与Na3PO4比较,化学活泼性比Na3PO4 (填“强”或“弱”),阴离子B的空间立体结构形状最有可能是 ;
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
21.(本题共9分) 有一瓶溶液只含Cl-、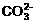 、
、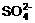 、Na+、
、Na+、 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
(1) 原溶液  白色沉淀
白色沉淀
(2) 将(1)所得溶液  放出使紫色石蕊试液变蓝的气体
放出使紫色石蕊试液变蓝的气体
(3) 原溶液中加BaCl2溶液不产生沉淀
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)原溶液中一定含有的离子是_____________________,一定不含有的离子是
可能含有的离子是
(2)有同学认为实验(4)可以省略,你认为呢?(填“可以”或“不可以”)
说明理由
(3)可能含有的离子如何加以确定?
20.(本题共6分) 在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类。请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内。
|
元素组 |
例外元素 |
其他元素所属类型编号 |
|
⑴S、N、Na、Mg |
|
|
|
⑵P、Sb、Sn、As |
|
|
|
⑶Rb、B、Te、Fe |
|
|
归属类型:①主族元素 ②过渡元素 ③同周期元素 ④同族元素 ⑤金属元素 ⑥非金属元素
19. (本题共6分). 第三周期元素中 ⑴元素的最高价氧化物所对应的水化物.其中酸性最强的酸是 ;⑵形成的共价单质中键长最长的是 键;键长最短的是 键⑶形成的非金属单质晶体中熔点最高的是 ,最低的是 .⑷形成的金属晶体中熔点最高的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com