
题目列表(包括答案和解析)
5.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成;在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见其变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体一定含有的是
A.CH4和NH3 B.HCl、H2和CO C.HCl和CO D.HCl、CO和CO2
4.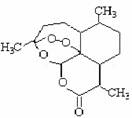 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如右图所示。有关该化合物的叙述正确的是
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如右图所示。有关该化合物的叙述正确的是
A.分子式为:C16H20O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.青蒿素与维生素一样是水溶性的
D.该化合物中含有过氧键,一定条件下有氧化性
3.试管装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面附近上下往复运动,下列说法不正确的是
A.此碱金属可能是钾或钠 B.反应一段时间煤油会燃烧
C.碱金属上下运动是由于与水反应产生了氢气 D.若是金属锂则不能观察到上述现象
2.2007年3月21日,我国公布了111号元素Rg(roentgenium)的中文名称。该元素名称及所在周期是
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
1.在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是
A.大量使用合成洗涤剂洗涤衣物
B.大量使用尿素替代碳酸氢铵以提高农作物产量
C.大量使用一次性竹、木筷子以推动林业发展
D.大量利用垃圾生产燃料、肥料“变废为宝”
23、(7分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)现在要除去1m3含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝__________g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_____________________________。
②已知金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水质量是多少?
22、(10分)已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:
a Fe + b NO3- + c H+ = d Fe2+ + f Fe3+ + g NO↑+ h N2O↑+ k H2O(化学计量数a~k均为正整数)。回答下列问题:
(1) 根据反应中离子的电荷守恒,可得b、c、d、f的关系式是(用一个代数式表示。下
同)
(2) 根据反应中的电子转移的总数相等,可得d、f、g、h的关系式是
(3) 根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是
(4) 若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;c的取值范围是 。
21、 (10分)物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。
(10分)物质间的三角转化关系是化学常见关系,如图,已知A、B、C都含有同一种元素X,且A、B、C之间可以相互转化。
(1)若A是常见金属的氢氧化物,且A+OH-→B,A+H+→C,写出:B→C的离子方程式
,B与C (填“能”或“不能”)共存。
(2)若A是酸性氧化物,且分子空间构型为直线型,B、C的焰色反应为黄色,相同条件下B的溶解度小于C的溶解度。则A的电子式是 ,B的俗名是 。写出:B固体→C固体的化学方程式 。
20、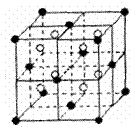 (9分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
(9分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (填化学式);
A和D的电负性较大的是 (填元素符号);
B和C的第一电离能较小的是 (填元素符号);
A和B的离子中,半径较小的是 (填离子符号);
构成C单质晶体的微粒以 键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如上图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。与一个“〇”距离最近的“●”有____个,与一个“●”距离最近的“●”有______个,该化合物的化学式是 。
19、(11分)按要求完成下列问题:
(1)写出基态Fe的电子排布式和Mg2+ 轨道表示式 、 。
(2)指出配合物K3[Co(CN)6] 中的中心离子、配位体及其配位数: 、 、 。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角 、 、 。
(4)若Pt(NH3)2 Cl2分子是平面结构,请画出Pt(NH3)2 Cl2可能的结构简式
、 。
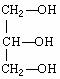
(5)下列分子若是手性分子,请用“ *”标出其手性碳原子。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com