
题目列表(包括答案和解析)
4.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在C(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
3.下列物质的保存方法正确的是
A.氢氟酸保存在塑料盖的玻璃瓶中 B.氯水盛放在棕色细口瓶中
C.液溴盛放在用橡皮塞的玻璃瓶中 D.固态碘放在棕色的细口瓶中
2.既含有极性键又含有非极性键的非极性分子是
A.H2O2 B.Na2O2 C.C2H2 D.C2H5OH
1. 有关化学用语正确的是
A. 次氯酸钙的化学式Ca(ClO)2 B. 乙酸的结构简式C2H4O2

 C. 氮气的电子式N N
D. 臭氧的化学式 18 8O
C. 氮气的电子式N N
D. 臭氧的化学式 18 8O
21A.物质结构与性质(12分)
(1)I.图表法、图象法是常用的科学研究方法。短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第_ ▲_族。
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:_ ▲_ (填“a”或“b”),理由是:_ ▲_。
 (2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为_ ▲_;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒 和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是_ ▲_;晶体内与每个“Ti”紧邻的氧原子数为_ ▲_个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为_▲。
21B.实验化学(12分)
我国中医药已有数千年历史,其独特的疗效使得经深加工的中药商品正逐步进入国际市场,但国外在进口中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素砷的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测定溶液至终点,消耗20.25ml 标准I2溶液,其中发生反应:
H3AsO3+I2+H2O→H3AsO4+I-+H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?_ ▲_
(2)配平离子反应方程式:_ ▲_H3AsO3+_ ▲_I2+H2O -_ ▲_H3AsO4+_ ▲_I-+_ ▲_H+
(3)0.2%的淀粉溶液的作用是_ ▲_,如何判断滴定到达终点?_ ▲_。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000mL而制得,请用一个离子反应方程式说明标准碘溶液形成过程_ ▲_。
(5)我国《药用植物及制剂进口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为_ ▲_mg/kg,故该草药样品_ ▲_(填“合格”或“不合格”)。
20.(12分)某结晶水合物中有两种阳离子和一种阴离子,其所含元素均为短周期元素,为确定其组成,某同学进行了如下实验:称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
(1)该结晶水合物中含有的两种阳离子是_ ▲_和_ ▲_,阴离子是_ ▲_。
(2)试通过计算确定该结晶水合物的化学式。
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。

19.(10分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,
将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是_ ▲_。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式:_ ▲_,该反应作氧化剂的物质是_ ▲_。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g); ΔH1=-574
kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g); ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=_ ▲_。
(3)①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:_ ▲_。
②合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C
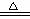 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_ ▲_g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为_ ▲_g。
18.(12分)已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此时容器的体积为V L,发生反应2A(g)+B(g)  2C(g),达平衡时,C的体积分数是0.4。
2C(g),达平衡时,C的体积分数是0.4。
(1)在此状态下达平衡时,其平衡常数为_ ▲_。
(2)若恒温恒压时开始充入4molC,达平衡时C的体积分数是▲ ,容器的体积为 ▲_L。
(3)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C的体积分数仍是0.4,压强为101kPa。则该容器的体积为_ ▲_ L。
 (4)若控制温度为t℃,另选一容积不变的密闭容器,其体积为VL, 开始充入一定量的A 和B,达到平衡时C的体积分数仍是0.4,则开始充入的A和B物质的量应满足 a<
(4)若控制温度为t℃,另选一容积不变的密闭容器,其体积为VL, 开始充入一定量的A 和B,达到平衡时C的体积分数仍是0.4,则开始充入的A和B物质的量应满足 a< <b,其中a为_ ▲_,b为_ ▲_(填数字)。
<b,其中a为_ ▲_,b为_ ▲_(填数字)。
17.(6分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂”的绿色工艺。该工艺流程如下图所示:

回答下列问题:
(1)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为_ ▲_
(2)锰的化合物用途广泛,例如MnO2、KMnO4都是重要的锰化合物
MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式_ ▲_。
②以上两种制备方法,方法一相对于方法二,所具有的优点是:_ ▲_。
③KMnO4粉末在低温下与浓H2SO4作用,可生成油状液体,它在0℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为_ ▲_。
16. (8分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
(8分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式_ ▲_;G的水溶液中,最多的阳离子是_ ▲_。
(2)写出K与H反应的离子方程式:_ ▲_;
G与H反应的化学方程式:_ ▲_。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释_ ▲_。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com