
题目列表(包括答案和解析)
14.FeS2与HNO3反应后的氧化产物为Fe3+和H2SO4,若反应中FeS2与HNO3的物质的量之比为1︰8,则HNO3的还原产物为 ( )
A.NO2 B.NO C.N2O D.N2O3
13. 往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g); △H>0,
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g); △H>0,
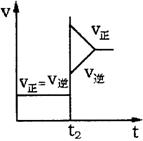 当达到平衡后,t2时改变反应的某一条件(混合气体总物质的
当达到平衡后,t2时改变反应的某一条件(混合气体总物质的
量不变),且造成容器内压强增大,下列说法正确的是( )
A.容器内气体颜色变深,混合气体密度增大
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象为(如右图)
12.某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Fe3+、H+、SO42-、Cl- D.Na+、K+、Cl-、SO42-
11.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为
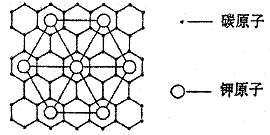 A、8 B、12 C、24 D、60
A、8 B、12 C、24 D、60
10.下列叙述不正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.硅胶可用于某些气体和袋装食品的干燥剂
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.电流通过胶体时,胶体就会发生丁达尔现象
9.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)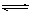 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的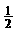
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
8.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.工业上用电解熔融MgCl2制取金属镁,故也用电解熔融AlCl3的方法制取金属铝
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
D.第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3
7.下列离子方程式书写正确的是
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合 :
Ba2++2OH-+2HCO3-→BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体: Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH容液混合溶液混合:
NH4++HCO3-+2OH-→NH3·H2O+ CO32-+ H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓
6.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.氧元素的氢化物只有H2O一种
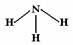 B.NH3分子的结构式为:
B.NH3分子的结构式为:
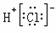 C.HCl的电子式为:
C.HCl的电子式为:
D.同主族元素的氢化物沸点均随分子量增大而升高
5.已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq) + OH-(aq) == H2O(l);△H = -57.3KJ/mol
CH3COOH(aq) + NaOH(aq) == CH3COONa(aq) + H2O(l);△H = -Q1KJ/mol
1/2H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) + H2O(l);△H =-Q2KJ/mol
HNO3(aq) + NaOH(aq) == NaNO3(aq) + H2O(l);△H =-Q3KJ/mol
上述反应均系在溶液中进行的反应,Q1、Q2、Q3的关系正确的是:
A.Q1> Q2= Q3 B. Q2 > Q1 > Q3
C.Q2 >Q3 >Q1 D. Q2 = Q3 > Q1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com