
题目列表(包括答案和解析)
13. (1)取代 酯化
(2)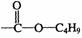
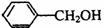
(3)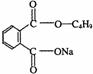 +
+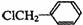

 +NaCl
+NaCl
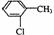
(4)
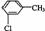

12.Ⅰ.AD
Ⅱ.(1)氢气与氨气的密度小于空气,而氧气的密度比空气大;
NO易与空气中的氧气反应;
将Ⅱ装置中加满水;
在Ⅱ装置中中加入难挥发,且不与NO2反应的有机溶剂
(2)能; 浓盐酸;KMnO4固体;溶液呈橙色;K2;K1
11.(1)Al2O3
(2)2Mg+CO2 = C+2MgO
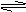 (3)AlO-+2H2O Al(OH)3(胶体)+OH-
(3)AlO-+2H2O Al(OH)3(胶体)+OH-
(4)2Na2O2+4H+=4Na++O2↑+2H2O
10.(1)①b ②c ③a
(2)①HClO4
②离子键、(极性)共价键
NaClO
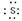 ③Na+ [
]2- Na+
③Na+ [
]2- Na+
④H2O2+H2S=====S↓+2H2O
无色溶液中产生淡黄色浑浊
1.C 2.D 3.C 4.B 5.A 6.C 7.D 8.A 9.D
13.(湖北省鄂南高中2008训练题3)某有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树脂具有良好相容性,是塑料工业主要增塑剂,可以用下列方法合成之:
已知: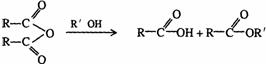
合成路线:
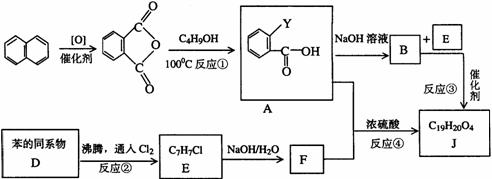
上述流程中:(ⅰ)反应 A→B仅发生中和反应,(ⅱ)F与浓溴水混合不产生白色沉淀。
(1)指出反应类型:反应② 反应④ 。
(2)写出结构简式:Y F 。
(3)写出B+E→J的化学方程式 。
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:
、 、 。
高三理综化学重组试题卷Ⅱ 4.9
12.Ⅰ、(编者原创)下列叙述正确的是
A. NO和NO2是大气的污染物,空气中的NO和NO2污染物主要来自石油产品和煤燃烧产物、汽车尾气以及硝酸工厂废气中等,NO与NO2等氮的氧化物可以计入空气污染指数
B. 硝酸是一种强氧化剂,可以与所有的金属发生氧化还原反应
C.工业上通常用铝热反应来冶炼铁
D.苯酚与溴的反应很灵敏,常用于苯酚的定性检验和定量测定
E.用玻璃棒蘸取某溶液,放在火焰上灼烧,观察到火焰呈现黄色,则说明该溶液中含有Na+
F浓硫酸具有强氧化性,所以不能用浓硫酸来干燥H2S、SO2等还原性气体
Ⅱ、(南充市2008 届第二次适应性考试)某兴趣小组的学生共同设计了如图 16 所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
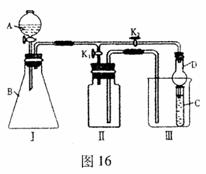 ( l )利用
I、II装置制取气体( K2关闭, K1打开),甲同学认为:利用II装置可以收集 H2、 NH3等气体。但不能收集 O2或 NO 等气体,其理由是__________________________________
( l )利用
I、II装置制取气体( K2关闭, K1打开),甲同学认为:利用II装置可以收集 H2、 NH3等气体。但不能收集 O2或 NO 等气体,其理由是__________________________________
______________________________________________。乙同学认为:将II装置作简单改进(不改变装置),也可收集 O2或 NO 等气体,但不能收集 NO2 气体,则改进的方法__________________________________
_______________________________________。将II装置再作简单改进(不改变装置),还可收集 NO2气体,则改进方法是__________________________________
_______________________________________。
( 2 )利用 I、II 装置能否验证氧化性: KMnO4> Cl2 > Br2___________(选填“能”或“不能” ) ,若不能,下列问题不做回答;若能,则在 A 中应加_____________, B 中应加_________________, C 中加人 NaBr 溶液, C 中可观察到的现象是_____________
_____________________,操作时应打开_________,关闭________(选填“K2”或“K1”)。
11.(湖北省鄂南高中2008训练题3)某同学在探究常见物质转化时,发现部分物质间存在如图所示三角转化关系。
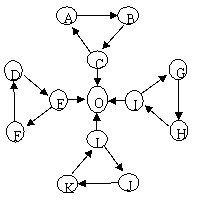 已知:①图中每个小三角中的三种物质至少含有一种相同元素。
已知:①图中每个小三角中的三种物质至少含有一种相同元素。
②D、J为固体单质,O为气体单质,其余物质为常见化合物。
③A能使品红溶液褪色,也能使澄清石灰水变浑浊;E为淡黄色
化合物,与C反应生成O,与L反应也能生成O;K、L
所含元素完全相同。
④I为两性氧化物,电解可生成O,G与L反应生成
难溶物H,H具有较强的吸附性。
试回答下列问题:
⑴ I的化学式:
⑵ 写出L-J反应的化学方程式
⑶ 常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:
⑷写出E与C反应的离子方程式:
10.(北京市崇文区2008统一练习)(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
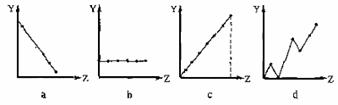
①ⅡA族元素的在外层电子数 。
②第3周期元素的最高化合价 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,
据此回答:
①N的最高价氧化物的水化物的化学式是 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度最小,则化合物A中的化学键类型为 ,若B为常见家用消毒剂的主要成分,则B的化学式是 。
③Z与M形成的稳定固体化合物的电子式为 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成一种可观察到的实验现象是 。
9.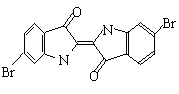 (河南省驻马店2008届第三次模拟) 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍。当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是
(河南省驻马店2008届第三次模拟) 泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍。当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是
A.泰雅紫分子的分子式为:C16H8N2Br2O2
B.1mol泰雅紫与H2加成最多需9molH2
C.泰雅紫属于烃的衍生物
D.检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com