
题目列表(包括答案和解析)
8、对于平衡体系mA(g)+nB(g)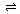 pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,
则m+n>p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为n:m
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
7、.常温下经测定某溶液中离子只有Na+、Ac-、H+、OH―四种,且离子浓度大小的排列顺序为:
c(Ac-)>c(Na+)>c(H+)>c(OH―)。其可能的情形是( )
A、该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B、0.1mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C、在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Ac-)>c(Na+) >c(OH-) >c(H+)
D、该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaAC溶液混合而成
6.据最新报道,科学家发现了如下反应:O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
10Fe2+ + 14Br- + 12Cl2 = 10Fe3+ + 7Br2 + 24Cl-
5.下列离子方程式正确的是( )
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:
Mg2+ + 2HCO3- + Ca2+ + 2OH- = CaCO 3↓ + 2H2O + MgCO3↓
D.向100 mL 0.1 mol/L的FeBr2溶液中通入0.012 mol Cl2:
10Fe2+ + 14Br- + 12Cl2 = 10Fe3+ + 7Br2 + 24Cl-
4.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1 L pH = 1的溶液中含有NA个H+离子
B.100 g 碳酸钙和碳酸氢钾的混合物中含有CO32-数目为3 NA
C.1 mol CH4与1 mol SiO2中所含的共价键数目均为4 NA
D.3.08 g 2CaSO4•H2O晶体中含有结晶水分子数目为0.02NA
3、下列有关说法不正确的是 ( )
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法
C.铝丝和铜丝用导线连接后插入冷的浓硝酸溶液中构成原电池,铝为负极
D、光化学烟雾的产生与人为排放碳氢化合物、氮氧化物有关
2、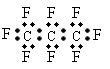 最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A、分子中三个碳原子可能处于同一直线上
B、全氟丙烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
1、2005年4月22日是第36个“世界地球日”,我国国土资源部确定今年“世界地球日”的主题为“善待地球-科学发展,构建和谐”。你认为下列行为中不符合这一主题的是( )
A、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B、控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
24.(9分)在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸然后分别慢慢加入组成相同的镁铝合金粉末,得到下表中有关数据(本题中假设反应前后溶液体积不发生变化),请回答:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/mL |
280 |
336 |
336 |
(1)甲组实验中,盐酸(选填“过量”、“适量”、“足量、不足量”,下同) ;乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 。
(3)合金中镁铝的物质的量之比为 。
(4)丙实验之后,向容器中加入一定量的1.00mol/LNaOH溶液,能使合金中的铝粉恰好溶解,再过滤出不溶性固体,则所得滤液中各溶质的物质的量浓度为 。
23.(5分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量/kJ |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
根据上述数据回答(1)-(3)题。
⑴下列氢化物中最稳定的是 ;
A.HCI B.HBr C.HI D.HF
⑵X2+H2=2HX(X代表Cl、Br、I)的反应是 (填“吸热”或“放热”)反应;
⑶相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 ;
⑷写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com