
题目列表(包括答案和解析)
8、一定条件下,可逆反应C(s) + CO2(g)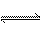 2CO(g);△H>0,达到平衡状态,现进行如下操作:
2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
7、一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A.B4C是一种分子晶体 B.B4C是一种离子晶体
C.B4C是一种原子晶体 D.该分子是有4个硼原子和1个碳原子构成
6、下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石):ΔH = +119 kJ· mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-aq)-===H2O(l);ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=-285.8 kJ· mol-1
5、下列实验中,颜色的变化与有关物质的强氧化性无关的是
A.乙烯使酸性高锰酸钾溶液褪色
B.SO2使滴有酚酞的红色NaOH溶液褪色
C.氯气使鲜花褪色
D.过氧化钠使品红溶液褪色
4、下列叙述正确的是
A.不能跟酸反应的氧化物一定能跟碱反应
B.同一主族元素的气态氢化物的相对分子质量越大,它的沸点一定越高
C.在CCl4、PCl3、HCl中各原子最外层均能达到8电子的稳定结构
D.升高温度可加快反应速率,其主要原因是反应物分子能量增加,活化分子百分数增加,使有效碰撞次数增多
3、用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是
A.不易生锈 B.导电性好 C.密度小 D.强度高
1.禽流感病毒对常用消毒剂十分敏感,容易将其杀灭,如氧化剂、稀酸等都能迅速破坏其活性,下列不能杀灭禽流感病毒的物质是
A.H2O2溶液 B.NaClO溶液 C.矿泉水 D.醋酸
22.(11分)实验室可通过多条途径得到氮气,常见的三种方法是:
 方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法一,将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三,将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
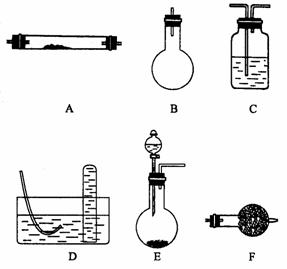
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):请回答下列问题:
(1)工业上合成氨的化学方程式为 。
(2)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)________ 作发生装置,该反应的化学方程式_________ ________ 在实验中生石灰的作用是 。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)____________ 。
(3)写出方法三制氮气的反应原理:(用化学方程式表示)
,在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于_____ _ _ 。
21. (12分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
(12分)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式
。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com