
题目列表(包括答案和解析)
24.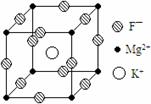 (10分)某种晶体的晶胞为立方体,结构如右图所示:
(10分)某种晶体的晶胞为立方体,结构如右图所示:
通过观察和计算,回答下列有关问题:
(1)晶体中每个Mg2+周围与它最邻近的Mg2+围成的
空 间构型是 ,每个F-周围与
它最邻近的K+有 个。
(2)若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K+置于晶胞的顶点,F-应占据立方体的 位置。
(3)设该晶体的密度为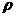 g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离。
g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离。
23.(10分)下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
|
|
|
|
|
|
a |
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
|
|
|
(1)g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
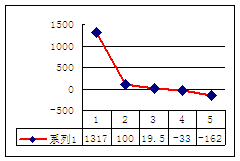
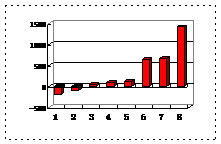
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
(3)a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
22.(8分)现有A、B、C、D、E五种原子序数依次增大的短周期元素。已知:A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素;D和E的原子序数之和为30;它们两两形成的化合物有甲、乙、丙、丁四种,这四种化合物中原子个数比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A∶C = 1∶1 |
B∶A = 1∶2 |
D∶E = 1∶3 |
B∶E = 1∶4 |
回答下列问题:
(1)甲分子的电子式为 ;丁分子的空间构型为 。
(2)已知:乙分子中所有原子共平面,则实验室制取乙的化学方程式为
。
(3)丙的水溶液加热蒸干再灼烧,最后所得固体的成分是 (写化学式)
21.(10分)《2004年江苏省环境公报》指出:2004年全省废水排放总量为46.6亿吨,其中工业废水排放量为26.3亿吨,生活污水排放量为20.3亿吨。废水中化学需氧量(COD)排放总量为85.4万吨,其中工业废水中COD排放量为29.8万吨,占COD排放总量的34.9%;生活污水中COD排放量为55.6万吨,占COD排放总量的65.1%。氨氮排放总量为7.3万吨,石油类排放总量为1804.3吨,挥发酚排放总量为74.3吨。
回答下列问题:
(1)江苏省水污染的特征是___________________________________________________________。
(2)某校研究性学习小组拟选择“本地水污染情况分析”的课题进行探究。
①如果你参加该课题的探究,写出你的子课题名称和你选择该子课题的理由:___________________________________________________________________________ ______________________________________。
②水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
(Ⅰ)配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
(Ⅱ)配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)氨基苯磺酸(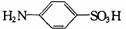 )粉末,实验结果如下表所示。
)粉末,实验结果如下表所示。
|
色阶序号 |
1 |
2 |
3 |
4 |
5 |
6 |
|
加入溶液B的体积(mL) |
0.0 |
2.0 |
4.0 |
6.0 |
8.0 |
10.0 |
|
反应后溶液颜色 |
由无色变为由浅到深的樱桃红色 |
(Ⅲ)检测:取10mL水样倒入比色管中,加少许氨基苯磺酸,显色后与标准色阶对比。
请填写以下空白:
a.比色法的基本依据是 ;
b.若水样显色后与色阶中的5号颜色相同,则表明水样中含NO2-含量为 mg/L。
c.用NaNO2直接配制溶液B的缺点是 。
d.如果水样显色后比6号还深,应采取的措施是 。
20.(10分)下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
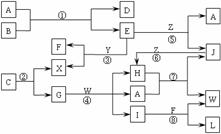 Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B的金属元素原子核外的K层和M层电子数相同。
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B的金属元素原子核外的K层和M层电子数相同。
请按要求填空:
(1)写出下列物质的化学式:B___________,C___________;
(2)上述反应中属于置换反应的是_________;不属于氧化还原反应的是__________;(填写反应代号)
(3)反应④的离子方程式为:_____________________________________________。
19.(8分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
(1)已知酸性FCH2COOH>CH3COOH,试推断:
①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)_________________。
(2)已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:
上述三种银盐在水中溶解度由大到小的顺序________________________。
(3)除HF外,其他卤化氢沸点随相对分子质量增大而增大,HF的沸点反常的原因是___
_________________________________________________________。
(4)已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为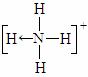
(→表示共用电子对由N原子单方面提供)。
请画出N4H44+的结构式_____________________。
18.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。

将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
(3)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 。
17.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
16.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.物质HClO4的氧化性大于HClO3
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.氯酸分解所得O2和C12的物质的量之比是确定不变的
第Ⅱ卷(非选择题 共86分)
15.2004年4月30号出版的《Science》杂志报道了中国科学家郑兰荪院士首次成功合成新型稳定小富勒烯C50Cl10,外侧有10个氯原子,其形状酷似太空船。有关C50Cl10的说法正确的是
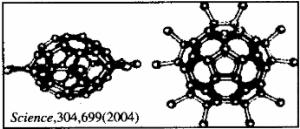
A.C50Cl10摩尔质量为955 g/mol B.C50Cl10晶体是原子晶体
C.C50Cl10分子中含有25个碳碳双键 D.C50Cl10分子中共用电子对数目为105个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com