
题目列表(包括答案和解析)
7、已知在FeSO4和Fe2(SO4)3组成的混和物中,硫元素的质量百分含量为a%,则混和物中铁元素的质量百分含量为
A (100-a)% B (100-2a)% C (100-3a)% D (100-4a)%
6、密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为
A 29.6% B 42.1% C 14.8mol/L D 6.22mol/L
5、下列有关阿佛加德罗常数(NA)的说法正确的有
A 标准状况下,11.2L SO3所含的原子数目为2NA
B 0.1mol H2O2催化分解,转移电子数为0.1 NA
C 0.1mol/L的100mL H2SO3溶液中,含有的离子数约为0.03 NA
D 3.2g Cu与10.0g 98%的H2SO4反应可得0.05NA个SO2气体分子
4、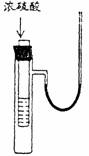 右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是
右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少量的水(已染成红色)。如沿小试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U型细玻管中可观察到的液面现象是
A 左高右低 B 左低右高
C 左右一样高 D 来回振动
3、下列关于浓硫酸的叙述正确的是
A 浓硫酸具有吸水性,因而能使蔗糖炭化
B 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D 浓硫酸在常温下能够使铁、铝等金属钝化
2、在常温、常压下将aL SO2和bL H2S混和,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为
A 1︰1 B 1︰2 C 1︰3 D 2︰1
1、在常温常压下,24mL H2S和O2的混和气点火燃烧,生成6mL SO2时,则原混和气体中H2S的体积为
A 6mL B 12mL C 15mL D 18mL
21.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
20、 (14分) 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
(14分) 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
(1)写出液态丁产生两种等电子粒子的电离方程式:
(2)室温下含有戊的盐溶液,其pH 。
A.>7 B.=7 C.<7 D.以上都有可能
(3)丙是目前重要的能源
①丙和丁在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其正极反应的电极方程式为
(4)甲、乙高温反应时,甲被破坏了1 mol共价键,则参加反应的乙为 g。
19. (8分)(1)某反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:
NH4++ O2→ NO3-+ H++ H2O
①配平上面化学方程式,将系数填入方框中。
②将铵态氮中的1mg氮转化成硝酸根中的氮,需氧气_________毫克。
(2)3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
NO3-+5CH3OH→ N2+ CO2+ H2O+ OH-
配平上面化学方程式,将系数填入方框中。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com