
题目列表(包括答案和解析)
16.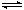 (12分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(12分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
 (1)图中共有两条曲线X和Y,其中曲线 表示NO2
(1)图中共有两条曲线X和Y,其中曲线 表示NO2
浓度随时间的变化;a、b、c、d四个点中,表示化学反应处
于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率
v(NO2)=
 ②15min时,反应2NO2(g) N2O4(g)在b点的浓度
②15min时,反应2NO2(g) N2O4(g)在b点的浓度
平衡常数K(b)=
 ③35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d)
K(b)
③35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d)
K(b)
(填“>”、“=”或“<”)
(3)①若要达到使NO2(s)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小玻璃容器的体积至1L,气体的颜色变化过程是 。
15.(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是 。
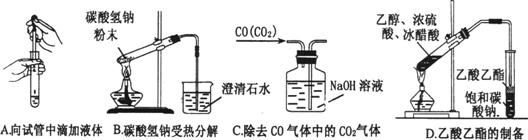
(3)下图为常见仪器的部分结构(有的仪器被放大)
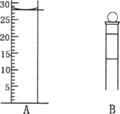
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是 (填字母标号)。
14、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
13.以下离子检验的结论可靠的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B. 通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明有I-
C. 往溶液中加入盐酸,产生的气体能使澄清石灰水变浑浊,说明有CO32-
D.往溶液中加入 BaC12溶液和稀HNO3 ,有白色沉淀生成,说明有SO42-
12.下列离子方程式书写正确的是:
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:
3Ba2+ + 6OH– + 2Al3+ + 3SO42–== 3BaSO4↓+ 2Al(OH)3↓
B.向硝酸银溶液中加入过量氨水:Ag+ + 2NH3·H2O = [Ag(NH3)2]+ + 2H2O
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2+ + SO42– == BaSO4↓
D.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
11.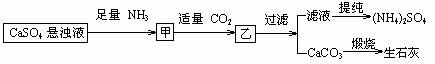 某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2 NH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
10.常温下,0.1 mol·L-1某一元酸(HA)溶液中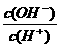 =1×10-1下列叙述正确的是
=1×10-1下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:
c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
9.用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是
A.阳极上析出5.6 mL O2(标准状况) B.阴极上析出32 mg Cu
C.阴极上析出11.2 mL H2(标准状况) D.阳极和阴极质量都无变化
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5 gSiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
7.ⅡA的铍在一定条件下可形成化合物Na2BeO2。下列有关铍及其化合物的叙述正确的是
A.氧化铍不能溶于盐酸 B.氢氧化铍易溶于水
C.单质铍可溶于氢氧化钠溶液生成氢气 D.Na2BeO2溶液呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com