
题目列表(包括答案和解析)
24.(6分)用简要文字和相应的离子方程式、电极反应式解释下列问题:
(1)用pH计(能精确测定溶液的pH值)测定一定浓度的CuCl2溶液,其pH=a,且a<7。该溶液pH<7的原因是
。
(2)将上述CuCl2溶液放入U形管中,并在U形管两端插入两支碳棒,用导线连接碳棒和电源,电解CuCl2溶液。电解时,用pH计测定两极附近溶液的pH值。
①测得连接负极的碳棒附近溶液的pH=a1,且a1>a,原因是 。
②测得连接正极的碳棒附近溶液的pH=a2,且a2<a,原因是
。
23.(16 分)Ⅰ.合成氨工业对化学和国防工业具有重要的意义。写出氨的两种重要用途
。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是 。(填编号)
① 固体氯化铵加热分解
② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液加热
④ 固态氯化铵与氢氧化钙混合加热
 Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)
实验操作:
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧胶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
请回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是
,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是
,C瓶内气体的成分是 。
(3)在步骤③中,先加热铁触媒的原因是
。
反应管E中发生反应的化学方程式是 。
22.(8分)下图表示的是用明矾 [KAl(SO4)2·12H2O] 制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
|
|
 |
 |
||||||
|
|
||||||

 ①
②
①
②
|
|
|



(1)进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 , 其反应的离子方程式为 。
(2)进行操作④时,所加入的试剂是 ,其目的是
, 同时要对反应混合物进行的操作是 。
21.(6分)下列有关实验的叙述,不正确的是(填序号) 。
①蒸干FeCl3溶液可以得到无水的氯化铁
②在氢氧化铁胶体中加少量硫酸会产生沉淀
③无法用分液漏斗将甘油和水的混合物分离
④用干燥洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,试纸完全变色后,跟标准比色卡比较
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
⑥硝酸、溴水不可以长期盛放在棕色滴瓶中
20. 将0.1L含有0.02molCuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,某电极的质量增重了0.64g。下列说法正确的是
A.质量增重的电极为阳极 B.电解过程中电子转移数为0.02NA
C.电解过程中某电极上只有Cl2产生 D.电解过程中pH增大
19.等质量的三份铁a、b和c,分别加入稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中表示其产生氢气总体积(V)与时间(t)的关系,其中可能正确的是

18. 在容积一定的密闭容器中,反应2A 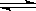 B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g) + C(g) 达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A. 正反应是吸热反应,且A不是气态 B. 正反应是放热反应,且A气态
C. 其他条件不变,加入少量C,该平衡向逆反应方向移动
D. 改变压强对该平衡的移动无影响
17. 多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是 A.6 B.5 C.4 D.3
16.将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A. 若V1>V2,则说明HA的酸性比HB的酸性强
B. 若V1>V2,则说明HA的酸性比HB的酸性弱
C. 因为两种酸溶液的pH相等,故V1一定等于V2
D. 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
15. a mol FeS 与 mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g B.(a+b)×189g
C.(a+b)mol D.(c
V- )mol
)mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com