
题目列表(包括答案和解析)
10.56 gFe 粉投人500g 稀HNO3中,两者恰好完全反应放出NO,溶液增重26g ,则反应后溶液中的金属阳离子 A.只有Fe3+ B.只有Fe2+
C.有Fe2+和Fe3+ D.无法确定
9.已知酸性: 综合考虑反应物的转化率和原
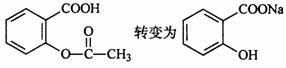
料成本等因素,将 的最佳方法是
A.与稀H2SO4 共热后,加人足量的NaOH 溶液 B.与稀H2SO4 共热后,加人足量的NaHCO3 溶液 C.与足量的NaOH 溶液共热后,再通人足量CO2 D.与足量的NaOH 溶液共热后,再加人适量H2SO4
8.氟气是氧化性最强的非金属单质。等物质的量的F2与NaOH 在稀溶液中反应生成NaF、H2O 和一种气体,该气体是
A.HF B.OF2
C.H2 D.O2
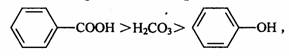
7.科学家已获得了极具理论研究意义的N4 分子,其结构为正四面体(如右图所示),与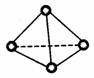 白磷分子相似。已知断裂1 mo1N 一N 键吸收193kJ 热量,断裂1 molN≡N 键吸收94IkJ 热量,则
白磷分子相似。已知断裂1 mo1N 一N 键吸收193kJ 热量,断裂1 molN≡N 键吸收94IkJ 热量,则
A.N4 的熔点比P4 高
B.1 molN4气体转化为N2时要吸收748kJ 能量 C.N4是N2的同系物
D.1 mol N4 气体转化为N :时要放出724kJ 能量
6.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE 保鲜膜可直接接触食品,PVC 保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是
A.PE、PVC 都属于链状高分子化合物,受热易熔化 B.PE、PVC 的单体都是不饱和烃,能使溴水褪色 C.焚烧PVC 保鲜膜会放出有毒气体HCl
D.废弃的PE 和PVC 均可回收利用以减少白色污染
29.(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
28.(10分)请根据下图作答:

已知:一个碳原子上连有两个羟基时,易发生下列转化:
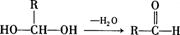
(1)E中含有的官能团是 。
(2)反应③的化学方 。
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为 。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种结构,写出其中一种的结构简式 。
27. (10分)聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:


 乙烯
甲
乙
PVC
乙烯
甲
乙
PVC
(1)乙是PVC的单体,其结构简式为 ;
(2)反应③的化学方程式为 ;
(3)写出以下反应类型:反应① ;反应② 。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸
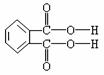
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP
(分子式为C10H10O4),DMP属于芳香酯,其结构简式为 。
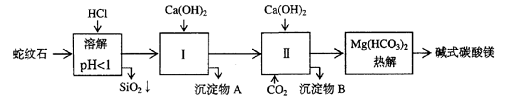
26.(14分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是__________________
(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③____________________________________
④____________________________________ ⑤MgO称量
(6)18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________ b =_________ C =_________
25.(10分)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw= 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com