
题目列表(包括答案和解析)
9.下列事实能说明亚硝酸是弱电解质的是
A 亚硝酸钠溶液的pH大于7 B 用亚硝酸溶液作导电试验,灯泡很暗 C亚硝酸溶液不与硫酸钠溶液反应恰好中和 需要10 gNaOH 固体 D亚硝酸能与NaOH溶液发生中和反应
8.用惰性电极电解50ml锰酸钾溶液:K2MnO4 +H2O KMnO4 +H2↑+ KOH(未配平),当生成112ml氢气(标准状况)时停止通电。下列判断正确的是
A K+浓度减小 B KMnO4在阳极区生成
C阴极周围溶液的pH值减小 D 反应过程中共转移0.005mol电子
7.根据相关事实,所的结论正确的是
A HCl的相对分子质量比HF大,故HCl的沸点比HF高
B苯不能使酸性高锰酸钾褪色,故苯没有还原性
C CO2通入苯酚钠溶液中产生浑浊,故酸性H2CO3>C6H5OH
 D 常温下白磷可自燃而氮气需在放电时才能与氧气反应,故非金属性P>N
D 常温下白磷可自燃而氮气需在放电时才能与氧气反应,故非金属性P>N
6.下列离子方程式中,只能表示一个化学反应的是
①CO32-+2H+==CO2↑+H2O ②Ba2++2OH--+2H++SO42--=BaSO4↓+2H2O
③ Ag++Cl-=AgCl↓④Fe+Cu2+== Fe2++Cu⑤Cl2+H2O=====H++Cl-+ HClO
A ①③ B ②④ C ②⑤ D 只有⑤
29.( 14 分)2007 年11 月,我国自行研制的长征三号甲运载火箭载着“嫦娥一号”探测器升空,成功实现了绕月飞行。第一、二级火箭使用的推进剂是液态偏二甲肼和四氧化二氮。已知偏二甲肼含C、H、N 三种元素,其中C、N 两元素的质量分数分别为40.0 %和46.7 % , 在气态时,偏二甲肼的密度是相同条件下H2密度的30 倍。请填写下列空白:
( l )偏二甲肼的分子式为________________;若0 . 2 mol 液态偏二甲肼与液态N2O4 完全反应,生成气态的N2、H2O 和CO2,同时放出510 kJ 热量,试写出该反应的热化学方程式:__________________________________________________________________________
( 2 )满足偏二甲肼分子式的同分异构体有____________ 种。写出符合分子中含两个甲基的结构简式:_________________________________________________。
( 3 )肼(N2H4)又称联氨,是一种可燃性液体,也可用作火箭燃料。肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH 溶液,放电时生成氮气和水,则肼一空气燃料电池放电时,负极的电极反应式是____________________________________。
( 4 )肼可看作是氨分子内的一个氢原子被氨基取代的衍生物,肼的水溶液呈弱碱性,是因为溶液中存在平衡:H2N一NH2+HZO ___________________________。
___________________________。
28.( l 2 分)有机物A 只含C、H、O 三种元素,相对分子质量为130 ,在酸性条件下,1 molA 水解得到1mol B 和l mol 乙二醇。B 能使溴水褪色,还能溶解碳酸钙,B 与H2的加成产物分子中有2 个甲基。请回答下列问题:
( l ) B 的相对分子质量为_____________________,结构简式是_______________。
( 2 ) 1 mol 乙二醇与2 mol B 反应的化学方程式是__________________________________________________________________________。

已知:
由丙烯合成B 可以经过下列五步反应:①与H2O 加成 ②催化氧化 ③与HCN 加成 ④水解 ⑤消去, 则反应② 的化学方程式是______________________________________,反应④ 的产物结构简式是________________。
( 4 )软质隐形眼镜常用A 经加聚反应生成的HEMA 制成超薄镜片,HEMA 的结构简式是_________________________________________________________________________。
27.( 16 分)A、B、C、D、G 都是含有同一种短周期元素的化合物,E 是氧化物,H 是单质。根据下图转化关系(反应条件及部分产物已略去)填空:
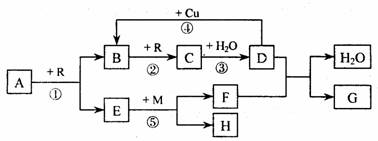
( l )若A、B、C、D、G 均含X 元素,且A 的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③ 是工业生产__________________的基本原理,M 的化学式是__________。其中反应① 的化学方程式是_________________________________________;反应④ 的离子方程式是________________________________________________。
( 2 )若A、B、C、D、G 均含Y 元素,Y 元素处于X的相邻周期、相邻族,G 可作净水剂,则反应①、②、③ 是工业生产______________________的基本原理,M 元素在周期表中的位置是____________________________。其中反应① 的化学方程式是_________
________________________;反应①一⑤ 中,既属于化合反应又属于非氧化还原反应的是___________________________。
26.(18 分)某化学学习小组的同学设计实验来探究草酸受热分解的产物,他们将草酸受热分解得到的气体通过如下图所示装置:
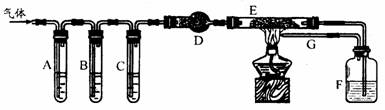
A、C、F 中盛装澄清石灰水,B 中盛NaOH 溶液,E 中装有CuO 。请填写下列空白:
(l)证明产物中有CO2的现象是___________________________________,证明产物中有CO 的现象是__________________________________________________。
(2)导管G 的作用是_______________________________________________。
(3)小李同学查阅相关资料发现:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究认为:草酸蒸气与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此需要在装置A 之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(4)如果在E 管中盛装CuO 和Cu2O的混合物,根据F 瓶增重可以测定混合物中CuO 的质量。当CuO 和Cu2O的混合物7.6g 全部被还原后,F 装置增重3.3g ,混合物中CuO 的质量为____________g ;当原混合物质量为a g ,反应后F 装置增重bg 时,b 的取值范围是___________________________________(用含a 的代数式表达)。
12.八角茴香含有一种抗禽流感病毒的重要成分一一莽草酸,其结构简式为:

则莽草酸不具有的性质是
A.遇FeC13 溶液呈紫色
B.能发生消去反应 C.能与H2发生加成反应
D.1 mol 莽草酸只能与1 mol NaOH 反应
l3.在一定温度、一定体积的密闭容器中有如下平衡:H2 (g) + I2 (g) 2HI
(g),已知H2和I2
的起始浓度均为a mol / L ,达平衡时HI 的浓度为bmol / L;若H2和I2的起始浓度均为2a
mol / L,则平衡时H2的物质的量浓度是
2HI
(g),已知H2和I2
的起始浓度均为a mol / L ,达平衡时HI 的浓度为bmol / L;若H2和I2的起始浓度均为2a
mol / L,则平衡时H2的物质的量浓度是
A.b mol / L B.mol / L
C.(2a 一b)mol / L D.( a 一 )mol / L
绵阳市高中2008 级第二次诊断性考试
理科综合能力测试化学试题
第II卷
(非选择题,共 10 题,共 174 分)
答第II卷前,考生务必将自己的姓名、准考证号用钢笔或圆珠笔(蓝、黑色)写在答题券密封线内相应的位置。答案写在答题卷上,不能答在试题卷上。
11.常温下,对于物质的量浓度相等、体积相同的NaCl溶液与NaF 溶液,下列判断错误的是
A.在NaCl 溶液中一定有c(Na+)+ c ( H+) = c (OH一)+ c( Cl-) B.在N 亦溶液中一定有:c(Na+)+ c ( H+) = c (OH一)+ c(F-)
C.NaCl 溶液中的氢离子浓度比NaF 溶液中的氢离子浓度大 D.由于F-水解,NaF 溶液中F- 减少n molF-,必然增加n mol OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com