
题目列表(包括答案和解析)
13.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.5kJ/mol。假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
A.40% B.50% C.60% D.70%
12.将白磷隔绝空气加热到260℃可转变为红磷。以下说法正确的是
A.白磷转变为红磷是一个吸热过程 B.红磷比白磷稳定
C.白磷转变为红磷需外界提供引发反应的能量 D.白磷比红磷稳定
11.热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(l);|△H|>297.3kJ/mol
B.1molSO2的键能总和大于1molS和1molO2键能之和
C.S(g)+O2(g)=SO2(l);|△H|<297.3kJ/mol
D.1molSO2的键能总和小于1molS和1molO2键能之和
10.已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H=Q1kJ/mol
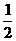 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=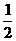 Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
Na2SO4(aq)+H2O(1)
△H=Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
9.含20.0NaOH的稀溶液与稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是
A.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=+28.7kJ/mol
B.1/2NaOH(aq)+1/2HCl(aq)=1/2NaCl(aq)+1/2H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
8.已知某温度下的热化学方程式:2SO2(气)+O2(气)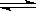 2SO3;△H=
-197KJ/mol,在同温同压下,向密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ;向另一相同的密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ。下列关系正确的是
(
)
2SO3;△H=
-197KJ/mol,在同温同压下,向密闭容器中通入2molSO2和1molO2,达平衡时放出热量Q1KJ;向另一相同的密闭容器中通入1.5molSO2,0.75molO2和0.5molSO3,达平衡时放出热量Q2KJ。下列关系正确的是
(
)
A.Q1=Q2=197 B.Q1=Q2<197 C.Q1<Q2<197 D.Q2<Q1<197
7.根据热化学方程式(101 KPa) S(s) +O2 (g)=SO2 (g); △H=-297.23KJ/mol分析下列说法不正确的是 ( )
A S的燃烧热为297.23KJ/mol
B S(g) +O2 (g)=SO2 (g) 放出的热量大于297.23KJ
C S(g) +O2 (g)=SO2 (g) 放出的热量小于297.23KJ
D 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量
5.现有 CO,H2,CO2组成的混合气体116.6升(标况),经完全燃烧后放出的总热量为867.9KJ,并生成18克H2O(L),已知2H2 (g)+O2 (g)=2H2O(L);△H=-571.6KJ/mol ,CO(g)+1/2O2=CO2 (g); △H=-282.8KJ/mol,则燃烧前混合气体中CO的体积分数最接近于 ( )
A 80% B 60% C 40% D 20% 6.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g)=N2O4(g); △H=+ 8.7kJ/mol N2H4(g) + O2(g)=N2(g) + 2H2O(g); △H=–534 kJ/mol 下列表示肼和N2O4反应的热化学方程式,正确的是 ( ) A. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–1076.7 kJ/mol B. N2H4(g) + 1/2N2O4(g) =3/2N2(g) + 2H2O(g); △H=–1076.7 kJ/mol C. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–542.7 kJ/mol D. 2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g); △H=–1059.3 kJ/mol
4.使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:
C(s)+1/2O2(g)=CO(g) △H=-Q1kJ/mol,CO(g)+1/2O2(g)=CO2(g) △H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是 ( )
A.1/2Q2 kJ B.1/3Q2 kJ C.1/3(Q1+Q2)kJ D.1/3Q1 kJ
3.已知在25、101Kpa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40KJ热量。则表示上述反应的热化学方程式正确的是 ( )
A. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(g);△H =-96.80KJ/mol
B. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H =-11035.20KJ/mol
C. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);△H =+11035.20KJ/mol
D. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(g);△H =-96.80KJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com