
题目列表(包括答案和解析)
8. (2分)化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量。以下部分共价键键能数据:H-S 364 kJ/mol,S-S 266 kJ/mol ,S=O 522 kJ/mol ,H-O 464 kJ/mol。
(1)试根据这些数据计算下面这个反应的反应热:2H2S(g)+SO2(g)=3S(g)+2H2O; △H= -Q kJ/mol,反应产物中的S实为S8,实际分子是一个8元环状分子(如图)。求Q。
S S S S

S S S S
7.物质的生成热可定义为:由稳定单质生成1mol物质所放出的热量,如CO2气体的生成热就是1molC完全燃烧生成CO2气体时放出的热量,已知下列几种化合物的生成热分别是
|
化合物 |
葡萄糖 |
H2O(l) |
CO2 |
|
生成热kJ/mol |
1259.8 |
285.8 |
393.5 |
则1kg葡萄糖在人体内完全氧化生成CO2气体和液态水,最多可提供______kJ能量。
6. (7分)已知C(s、金刚石)+O2==CO2(g);ΔH=-395.4kJ/mol,C(s、石墨)+O2==CO2(g);ΔH=-393.5kJ/mol。且知石墨的密度大于金刚石。
(1)石墨和金刚石相比,____的稳定性更大,石墨转化为金刚石的热化学方程式为____________。
(2)石墨中C-C键键能______金刚石中C-C键键能。石墨的熔点______金刚石(均填“大于”、“小于”或“等于”)。
(3)理论上能否用石墨合成金刚石?____,若能,需要的条件是___________。
5. (2分) 已知下列热化学方程式的热效应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H1=-26.7kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H2=-50.75kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)十CO2(g);△H3=-36.5kJ/mol
不用查表,计算下列反应的△H。FeO(s)+CO(g)=Fe(s)+CO2(g)
4. (6分) (1)肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为 。
(2)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为
;又知H2O(l) H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ。
3. (6分) 一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔溶于自身的结晶水中,又同时吸收热量,它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点℃ |
40~50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/相对分子质量) |
49.7 |
37.3 |
77.0 |
100.1 |
(1)上述潜热材料中最适宜应用的两种盐是______ 、________________。
(2)实际应用时最常用的(根据来源和成本考虑)应该是_____________ 。
2. (9分)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
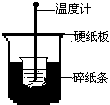 (2)烧杯间填满碎纸条的作用是_____________
。
(2)烧杯间填满碎纸条的作用是_____________
。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
1.(8分)已知下列几种烷烃的燃烧热如下:
|
烷 烃 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
己烷 |
|
燃烧热/(kJ·mol-1) |
890.3 |
1559.8 |
2219.9 |
2877.0 |
3536.2 |
4163.1 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480KJ。
(1)试写出乙烷气体燃烧的热化学方程式_______________ ;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是____________________
(4)根据(3)的近似规律可预测癸烷的燃烧热约为________ _ kJ·mol-1。
15. 右图是198K时N2与H2反应过程中能量变化的( )
右图是198K时N2与H2反应过程中能量变化的( )
曲线图。下列叙述正确的是
A.该反应的热化学方程式为:
N2+3H2
 2NH3,△H=-92kJ·mol-1
2NH3,△H=-92kJ·mol-1
B.b曲线是加入正催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度体积一定的条件下,通入1molN2和3molH2反应后放出的热 量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ则184>Q2 >2Q1
14.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
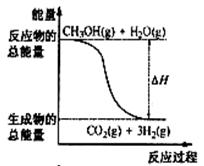
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.据盖斯定律和反应①和②可确定通常情况下氢气的燃烧热
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com