
题目列表(包括答案和解析)
2.下列叙述正确的是
A 日常生活中无水乙醇常用于杀菌消毒
B 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C目前加碘食盐中主要添加的KIO3
D在PH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在阴离子Cl- \NO3- \SO42-
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
36. (5分)
解析:(1)这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1;所以,该化合物的化学式为CaTiO3。
(2)钛位于立方体的顶点上,与一个钛离子距离最近的钛离子是与它共棱的。从上面立方晶胞进行堆积的图2和图3可以看出,在X轴或Y轴或Z轴上,与它共棱的离子都是二个,所以,共6个。
(3)这是个综合性较大的习题。设这种立方晶胞的边长是b,那么,钙离子与钛离子之间
的距离是体对角线的一半,即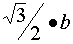 。
。
下面求b。因为每个立方体的体积为b3,而NA个这样的立方体堆积到一起就是1mol晶体,其质量为Mg,其体积为Mg/ag/cm3=M/a
cm3。所以,NA·b3=M/a cm3,所以, ,
,
所以,题中所求距离为  。
。
35. (6分)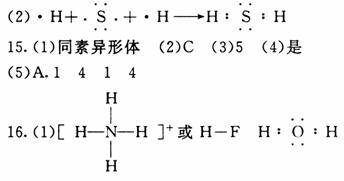
34.((8分)1) 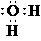 (1分)
(1分)
(2)Cl2+2OH- Cl-+C1O-+H2O(1分)
Cl-+C1O-+H2O(1分)
(3)4AlCl3+6Na2O2+6H2O 4Al(OH)3↓+12NaCl+3O2↑(2分)
4Al(OH)3↓+12NaCl+3O2↑(2分)
(4)2C1--2e- Cl2(1分) 阴(1分)
在阴极H+不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红(2分)
Cl2(1分) 阴(1分)
在阴极H+不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中c(OH-)>c(H+),所以阴极附近溶液变红(2分)
33.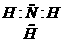
 (14分)(1)H C N O (2)3H2+N2
2NH3
(14分)(1)H C N O (2)3H2+N2
2NH3
三角锥形 NO,NO2
 (3)NH4++H2O?NH3·H2O+H+ 2分 (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
(3)NH4++H2O?NH3·H2O+H+ 2分 (4)NH4++HCO3-+2OH-=NH3↑+ +2H2O
2分
(5)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) 2分(其它1分)
提示:(1)X元素原子形成的离子就是一个质子,则X为氢元素。Y原子的最外层电子数是内层电子数的2倍,Y只能是碳元素。周期表中相邻元素的单质常温下均为无色气体的只有氮气和氧气。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,则该盐为NH4HO3,由于NH4+水解,溶液呈酸性,所以长期使用NH4NO3会使土壤酸化。
(4)这四种元素组成的原子个数比为5∶1∶1∶3的化合物是NH4HCO3,它与足量NaOH反应生成NH3和Na2CO3,即NH4HCO3+2NaOH?NH3↑+Na2CO3+2H2O。
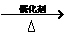
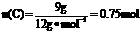 (5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
(5)9g碳为
生成的CO2也是0.75mol,n(NaOH)=1L×1mol·L-1=1mol。
没完全吸收后,溶液中Na2CO3、HaHCO3物质的量分别为x、y,由Na原子守恒、C原子守恒可得

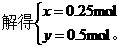
所以完全吸收后的溶液中含0.25mol Na2CO3和0.5mol NaHCO3的混合物,溶液中离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
31.(每空1分)(1)8;6(2)60°;正四面体6;P4O10。(3)原子;4。(4) 12;30。
32(共7分)
(1)6Na+2Al3++6H2O=6Na++Al(OH)3↓+3H2↑
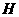 (2)
(2)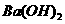 ,
,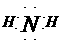 ,三角锥型
,三角锥型
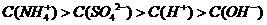
21、B 2 2、C 23、A 24、D 25、AD 2 6、BD 27、D 28、C29.B30D
36. (5分)(1) 。(2) (3 ) 。
|
1 |
B |
2 |
C |
3 |
C |
4 |
C |
5 |
C |
6 |
B |
7 |
B |
8 |
A |
|
9 |
D |
10 |
C |
11 |
A |
12 |
C |
13 |
C |
14 |
B |
15 |
B |
|
35. (6分)(1) 。(2)
(3) (4)
(5) PbS+ O3-- PbSO4+ O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com