
题目列表(包括答案和解析)
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
|
KI+3H2O KIO3+3H2↑。下列有关说法正确的是( )
 A.电解时,石墨作阴极,不锈钢作阳极
A.电解时,石墨作阴极,不锈钢作阳极
|
C.电解时,阴极区域溶液酸性增加
D.电解时,阳极反应是:I¯-6e¯+3H2O=IO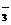 +6H+
+6H+
4.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列对有关实验事实的解释正确的是
A.溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
B.用惰性电极电解相同浓度的Cu(NO3)2和AgNO3混合溶液,阴极首先析出的是Ag,说明Ag+ 的还原性比Cu2+ 强
C.常温下,将铝片放入浓硫酸中无明显现象,说明铝不和冷的浓硫酸反应
D.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
3.石棉是一类价格低廉的硅酸盐材料,但是有毒,能使人患肺癌。一种叫矿青石棉的化学式为:Na2Fe5Si8O22(OH)2。它用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是
A.该物质中Fe元素的化合价为+2价,它属于硅酸盐
B.该物质的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol该物质能和18molHNO3反应,也能与18mol盐酸反应
D.这种石棉属于新型无机非金属材料
2.
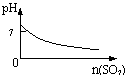 下列实验过程中产生的现象与对应的图形符合的是
下列实验过程中产生的现象与对应的图形符合的是
A.盐酸中加入NaAlO2溶液 B.SO2气体通入溴水中
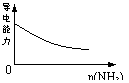

C.pH=1的醋酸与盐酸分别加水稀释 D.氨气通入醋酸溶液中
1.化学是一门实用的、中心的学科,生活中的许多问题常涉及到化学知识。它在给经济发展
和生活带来方便的同时,如果运用不当也会产生负面的影响。下列有关叙述不正确的是
A.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量
B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等。电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害。所以废旧电池必须回收再利用
C.明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆”,所以饮用水的生产不能大量采用明矾作净水剂
D.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌。自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质
21.(12分)将3.2gCu溶于amol·L-1过量的硝酸30mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol·L-1。求:
(1)稀释后溶液中氢离子的物质的量浓度为 。
(2)生成的气体中NO2的物质的量为 ,NO的物质的量为 (用含a的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
(4)氮的氧化物与氨气在一定条件下可以反应生成N2和H2O。若NO2与NO的混合气体平均组成可以表示为NOx,1体积NH3与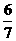 体积的NOx刚好完全反应,则x值为 。
体积的NOx刚好完全反应,则x值为 。
20.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-aKJ·mol-1。请写出B与C提稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
19.(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。B、E同主族,它们的单质以及它们之间反应生成的化合物在常温时状态相同,形成的晶体类型也相同;A与C、D与C之间都能形成原子个数比分别为2:1和1:1的两种化合物。试解答下列有关问题:
(1)B、E单质以及它们之间反应生成的化合物熔点由高到低的顺序为
(填元素符号或化学式)。
(2)C与D形成的化合物的电子式为: 。
(3)实验室可由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为: 。
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式,并标出电子转移的方向和数目 。
18.(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
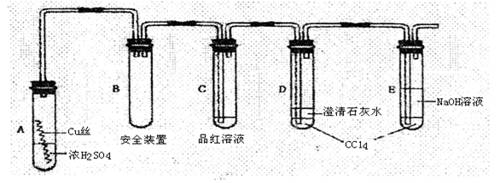
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流滴录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝成硫发生了反应,我查资料发现:2Cu+S=Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
。
17.(12分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
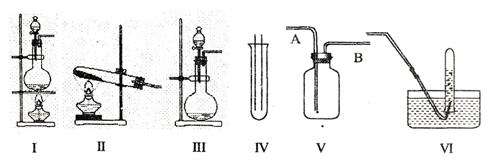
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,试完成并配平下列离子方程式:
MnO4-+ C1-+ H+- Mn2++
C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用
溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com