
题目列表(包括答案和解析)
16、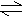 对可逆反应:N2+
3H2
2NH3(正反应放热)达平衡时,若分别增大压强和升高温度,两种情况下,对平衡体系正逆反应速率影响较大的依次是
对可逆反应:N2+
3H2
2NH3(正反应放热)达平衡时,若分别增大压强和升高温度,两种情况下,对平衡体系正逆反应速率影响较大的依次是
A、正反应速率,正反应速率 B、逆反应速率,逆反应速率
C、正反应速率,逆反应速率 D、逆反应速率,正反应速率
15、下列离子方程式书写不正确的是
A、将NaHSO4溶液滴加到Ba(OH)2溶液中至沉淀完全:Ba2++OH-+H++SO42-==== BaSO4↓+H2O
B、常温下向碳酸氢钙溶液中加入少量NaOH溶液:HCO3-+OH-==== CO32-+H2O
C、过量铁与稀HNO3反应:3Fe+8H++2NO3-==== 3Fe2++2NO↑+4H2O
D、在亚硫酸钠溶液中加入过量双氧水:2SO32-+H2O2 ==== 2SO42-+ 2H+
14、下列除去杂质的实验方法正确的是
A、除去CO中少量O2:通过灼热的Cu网后收集气体
B、除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C、除去NO2中的少量NO:再通入适量O2
D、除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
13、下列热化学方程式中△H的数值能表示可燃物燃烧热的是
A、CO(g)+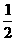 O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol
B、CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C、2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D、H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
12、0.1mol/L的NaOH溶液0.2L,通入44.8mL(S.T.P.)H2S,所得溶液离子浓度大小关系正确的是
A、c(Na+)>c(OH-)>c(S2-) >c(HS-) B、c(Na+)=c(H2S)+c(HS-)+c(S2-)
C、c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-) D、c(S2-)+c(OH-)=c(H+)+c(H2S)
11、下列各物质的熔点按由低到高的顺序排列是
A、石墨、金刚石、晶体硅 B、钾、钠、镁 C、冰、干冰、冰晶石 D、晶体硅、硅铝合金、铝
10、氯酸钾和二氧化锰混合加热充分反应后冷却,在残留物中加入浓H2SO4并加热,产生的气体是( )
A、只有O2 B、只有SO2 C、Cl2和HCl D、只有HCl
9、关于某无色溶液中所含离子的鉴别,下列判断正确的是
A、加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C、通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D、加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
8、设NA代表阿伏加德罗常数,下列说法正确的是
A、将标准状况下4.48 L NO与2.24 L O2混合在一密闭容器中,容器内分子总数为0.2 NA
B、7.8 g Na2O2与足量CO2充分反应,转移电子数为0.2 NA
C、常温常压下,8.4 g NaF 晶体中,F-数目为0.2 NA
D、一定量的NaOH溶液与足量Al反应,每产生2.24 L H2,Al便失去电子0.2 NA
7、氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应 D、生成1molN2有6mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com