
题目列表(包括答案和解析)
6.下列分子所含电子总数与氩原子不相同的是 ( )
 A.F2 B.CH3OH C.SO2 D.N2H4
A.F2 B.CH3OH C.SO2 D.N2H4
5.关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
4. 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
3.2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
2.t℃时,CuSO4的溶解度为A g,在该温度时,向(100+A)g饱和CuSO4溶液中加入A g无水CuSO4粉末后,得到一定量的蓝色CuSO4晶体.取出该晶体投入多少克水中,才能使溶液在t ℃时恰好饱和
A. (100+A)g B. 100g C. (100+2A)g D.无法计算
1.下列叙述正确的是 ( )
A.铁制品在干燥的空气中易生锈
B.用浓烧碱溶液洗衣服上的油污
C.硫酸铜用于自来水消毒
D.光导纤维是一种高质量传导光的玻璃纤维
24.某化工厂每小时生产98%(质量分数)硫酸a t(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为 m3。
(2)为满足题设需求,b%的下限等于 。
23.工业上为处理含有Cr2O72-离子的酸性废水采用如下方法:在工业废水中加入适量NaCl粉末,然后以铁为电极电解,最后将Cr2O72-以Cr(OH)3形式沉淀下来而除去,还生成Fe(OH)3沉淀,这种处理方法可使工业废水中Cr2O72-含量达到国家规定的排放标准。试回答:
(1)在工业废水中加入NaCl的作用是: 。
(2)有关电极反应方程式是: 。
(3)由Cr2O72-转化为Cr3+的离子方程式是: 。
(4)电解过程中工业废水由酸性变碱性的原因是 。
(5)如不用电解法而用绿矾石灰法处理上述工业废水,其主要反应化学方程式为:H2Cr2O7 + 6FeSO4 + 6H2SO4 ==== 3Fe2(SO4)3 + Cr2(SO4)3 + 7H2O Cr3+ + 3OH- ==== Cr(OH)3↓,现用上述方法处理1×104含铬(+6价)78 mg·L-1的废水需用绿矾多少千克?
22.为了将某溶液中存在的四种阳离子分开,设计了如下的实验方案。在下表中的方框内填入适当物质的化学式(或适当的离子符号),并写出①、②、③、④、⑤、⑥、⑦有关的离子方程式。
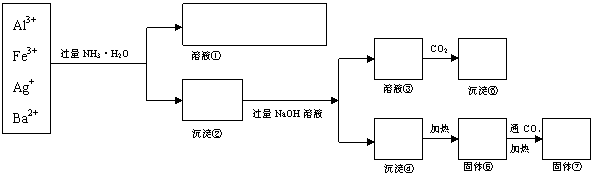


 溶液①: 沉淀②: 溶液③:
溶液①: 沉淀②: 溶液③:



 沉淀④: 沉淀⑤: 固体⑥: 固体⑦:
沉淀④: 沉淀⑤: 固体⑥: 固体⑦:
离子方程式
① 、 。
② 。
③ 。
21.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现在0.001 mol·L-1 KMnO4和未知浓度的无色NaHSO3溶液。反应的离子方程是2MnO4- + 5HSO3- ==== 2Mn2+ + 5SO42- + 3H2O。填空回答问题:
(1)该滴定实验所需仪器为下列中的
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶
E.铁架台 F.滴定管夹 G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不用 (填“酸”或“碱”)式滴定管盛入高锰酸钾溶液。试分析原因: 。
(3)选何种指示剂,说明理由 。
(4)滴定前平视KMnO4溶液,刻度为a mL,滴定后俯视液面刻度为b mL,则(b - a)mL比实际KMnO4溶液体积 (填“多”或“少”)。根据(b - a)mL计算得到的待测浓度,比实际浓度 (填“大”或“小”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com