
题目列表(包括答案和解析)
1.2007年9月1日,经国务院批准,国家发改委、中宣部等十七个部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是 ( )
|
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应:2CO+2NO 2CO2+N2
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①-⑥中符合原子经济性的是 。
(3)写出下列转化的化学方程式:② ,③ 。
写出有关反应的类型:② ⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
29.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)ZW晶体的结构示意图如下。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023
mol-1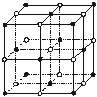 ,则ZW晶体中两个最近的Z离子中心间的距离为
,则ZW晶体中两个最近的Z离子中心间的距离为
27.咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色。

(1)咖啡酸中含氧官能团的名称为 。
(2)咖啡酸可以发生的反应是 (填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)咖啡酸可看作1,3,4一三取代苯,其中两个相同的官能团位于邻位,取
代基中不含支链。则咖啡酸的结构简式为 。
(4)3.6g咖啡酸与足量碳酸氢钠反应生成气体(标准状况) mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C12H16O4,该物质在一定条件下
可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡跟该芳香醇在一定条件下反应生成CPAE的化学方程式为 。
26. (10分)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
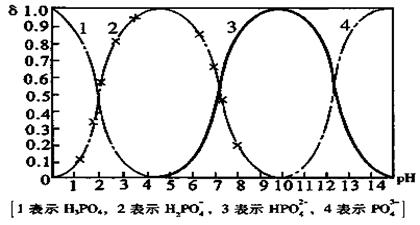
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
。
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是 。
(3)从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”、或“中”),其原因是 。
(4)在Na3PO4溶液中,c(Na+)/ c(PO43-) 3(填“>”、“==”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/ c(PO43-)的值减小,原因是 。
25. (10分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
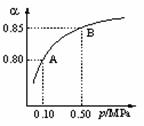 (1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
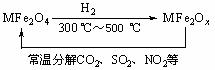
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
23. (11分) 在实验室可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。请填写下列空白:
( l )制取氯气时,在烧瓶里加人一定量的二氧化锰.通过_____________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_____________________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
 ( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
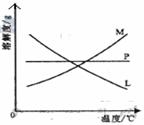
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_____________________(填写编号字母);
从②的试管中分离出该晶体的方法是__________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________________________ |
|
然后溶液从无色逐渐变为____色 |
_______________________________________________ |
22.(8分) 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
 ②样品处理
②样品处理
③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100mL0.01mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要: 、 。
②步骤②脱色过程包括加入: (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
③比色法确定待测液的浓度其原理是
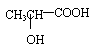 ④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
④若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学
方程式:
21.(10分)某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失。大家经查阅资料后,发现可能的原因是发生了下列反应:AgI+I- [AgI2]-。
[AgI2]-。
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验。
实验1:向浓KI溶液中滴加AgNO3溶液,现象为 。
实验2:向AgNO3溶液中滴加稀KI溶液,有黄色沉淀生成;再
。
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀。请解释出现沉淀的原因 。
(3)丙同学在实验所得的溶液中滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色。大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是 ;请设计简单的实验说明不会产生AgCl沉淀: 。
20.常温下,下列有关叙述正确的是
A.NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6mol/L
B.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①>②>③
C. Na2CO3溶液中, c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液 体积V(总)≥20mL
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com