
题目列表(包括答案和解析)
1.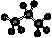 下列化学用语表达正确的是
下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
 B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
3.在实验室中,下列除去杂质的方法正确的是 A.硝基苯中混有浓HNO3和H2SO4,将其倒入到NaOH溶液中,静置,分液
B.乙烷中混有乙烯.通过氢气在一定条件下反应,使乙烯转化为乙烷
C..溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴
D.乙烯中混有SO2 ,通入溴水溶液中洗气
4,经检验,某酸雨的成分除含有少量H+和极少量OH-外,还有Na+、Cl-、NH+4、
SO2-4等离子,已知c(Na+)=7×10-6mol·L-1,c(Cl-)=3.5×10-5mol·L-1,c(NH+4)=2.3×10-5mol·L-1,c(SO2-4) =2.5×10-6 mol·L-1,则该酸雨的pH为
A.3 B.4 C.5 D.6
5,某学生欲完成反应2HCl+2Ag=2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是

6,下列各组离子,在指定环境中一定能大量共存的是
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.加入铝粉能放出氢气的溶液中:CO32-、H+、I-、NO3-
C.由水电离出的c(H+)=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
D.能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- 7,设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,2.24L苯中含有碳原子数约为0.6NA
B.1L0.2mol/LNa2S溶液中含有的硫离子数为0.2NA
C.1molC20H42的分子中含有的共价键数目为61NA
D.5.6g铁粉与硝酸反应失去的电子数一定为0.3NA
8, 有机物 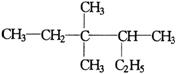 的正确命名为
的正确命名为
A.2-乙基-3,3-二甲基-4-乙基戊烷 B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基已烷 D.2,3,3-三甲基已烷
9,现有Mg、Al混合物粉末10.2克,将它溶解在500ml 4mol/L的盐酸中,若要使沉淀量达到最大值,则需要加入2mol/LNaOH溶液体积是
A.500ml B.1000ml C.2000ml D.不能确
10,在20 mL pH=2的醋酸溶液中,加入V mLpH=12的NaOH溶液。则下列说法正确的是
A.如果V=20,则所得混合溶液的pH大于7
B.当V=20时,混合溶液中离子浓度大小关系为:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.如果所得混合溶液的pH=7,则V小于20
D.所得混合溶液中一定存在c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
11,下列说法正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-=Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.钢铁发生电化腐蚀的正极反应式:Fe-2e- =Fe2+
12,已知NaHSO4在水中的电离方程式为:NaHSO4
= Na+ + H+ + SO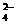 。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
13,工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是

14,向容积为2 L的密闭容器中充人2 mol A气体和1
mol B气体,在一定条件下发生如下反应:2A(g)+B(g)  3C(g);经2
s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2
s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
15,下列离子方程式正确的是
A.FeS放入稀盐酸溶液中:FeS+2H+=Fe2++H2S↑
B.足量的氯气通入FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
C.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2-+4H+=Al3++2H2O
D.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+
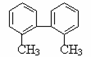 16,已知C-C可以绕键轴旋转,结构简式为
的烃,下列说法正确的是
16,已知C-C可以绕键轴旋转,结构简式为
的烃,下列说法正确的是
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯代物最多有4种
D.该烃是苯的同系物
21.(12分)将3.2gCu溶于amol·L-1过量的硝酸30mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol·L-1。求:
(1)稀释后溶液中氢离子的物质的量浓度为 。
(2)生成的气体中NO2的物质的量为 ,NO的物质的量为 (用含a的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
(4)氮的氧化物与氨气在一定条件下可以反应生成N2和H2O。若NO2与NO的混合气体平均组成可以表示为NOx,1体积NH3与 体积的NOx刚好完全反应,则x值为
。
体积的NOx刚好完全反应,则x值为
。
20.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。
。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);
△H=-aKJ·mol-1。请写出B与C提稀溶液反应的热化学方程式
。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 。
19.(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。B、E同主族,它们的单质以及它们之间反应生成的化合物在常温时状态相同,形成的晶体类型也相同;A与C、D与C之间都能形成原子个数比分别为2:1和1:1的两种化合物。试解答下列有关问题:
(1)B、E单质以及它们之间反应生成的化合物熔点由高到低的顺序为
(填元素符号或化学式)。
(2)C与D形成的化合物的电子式为: 。
(3)实验室可由B、C、D组成的化合物为反应物之一制取由A、C、D组成的化合物,反应的化学方程式为: 。
(4)写出E单质与A、C、D形成的化合物的水溶液反应的离子方程式,并标出电子转移的方向和数目 。
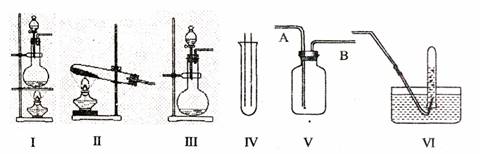 17.(12分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
17.(12分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,试完成并配平下列离子方程式:
MnO4-+ C1-+ H+- Mn2++
C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用
溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
18.(14分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
 实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录。
|
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CC14的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 。(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对此,学生2提出的猜想的:铜与浓硫酸反应生成的硫酸铜水解溶液呈酸性。
你的猜想是: 。
请你设计一个简单的实验以验证你的猜想:
。
0.51mol·L-1
D.将1mol·L-1的盐酸与5mol·L-1的盐酸等质量混合后,所得盐酸的物质的量浓度为3mol·L-1
|
 16.向一定体积含HC1、H2SO4、NH4NO、A1C13的混合溶液中逐滴加入Ba(OH)2溶液,溶液中产生沉淀的物质的量与加入Ba(OH)2溶液的体积关系正确的是 ( )
16.向一定体积含HC1、H2SO4、NH4NO、A1C13的混合溶液中逐滴加入Ba(OH)2溶液,溶液中产生沉淀的物质的量与加入Ba(OH)2溶液的体积关系正确的是 ( )
第Ⅱ卷(非选择题 共62分)
15.对于1mol·L-1的盐酸,下列叙述正确的是(忽略溶液混合时的体积变化) ( )
A.标准准状下22.4LHC1溶液1L水中配成溶液,即可得到1mol·L-1的盐酸
B.1mol·L-1的盐酸的质量分数小于3.65%
C.将1mol·L-1的盐酸与水等质量混合后,所得盐酸的物质的量浓度大于
14.下列各组离子能在溶液中大量共存,在足量该溶液中加入少量Mg(OH)2固体,可以使Mg(OH)2固体溶解得到澄清溶液的是 ( )
A.Na+、NH4+、C1-、NO3- B.H+、Fe2+、C1-、NO3-
C.Na+、S2-、SO32-、SO42- D.K+、HCO3-、NO3-、A1O2-
13.关于VIA族和VIIA族元素的下列说法中正确的是 ( )
A.在同一周期,VIA族元素氢化物的稳定性比VIIA族的强
B.浓度都是0.01mol·L-1时,硫酸溶液的PH值比氯酸溶液的小
C.VIIA族单质的氧化性均比VIA族单质的氧化性强
D.加热时,硫酸钠比氯酸钠易分解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com