
题目列表(包括答案和解析)
1. 2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
2007 年诺贝尔化学奖德国科学家格哈德 · 埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
28、(8分)臭氧(O3)能与KI溶液反应, 生成氧气等。在反应后的溶液中滴入酚酞变为红色。若滴入淀粉则变为蓝色。为测定环境中空气的臭氧含量, 将0℃、1.01×105Pa的空气33.6m3通过KI溶液, 使反应完全, 在所得溶液中用0.0100mol·L-1的Na2S2O3溶液60.0mL恰好滴定达终点, 反应为:
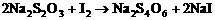
(1)臭氧通入KI溶液中的化学方程式是 ,每消耗1molO3,转移__________ mol e-
(2)计算大气中臭氧的体积分数。(写出计算过程)
27、(12分)某工厂废液中含有大量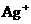 、
、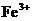 、
、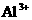 ,用下列图示方法进行分离利用(部分反应条件省略):(已知试剂z是医药工业中常用的有甜味的白色晶体)
,用下列图示方法进行分离利用(部分反应条件省略):(已知试剂z是医药工业中常用的有甜味的白色晶体)
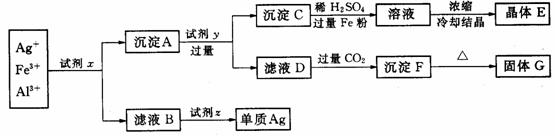
(1)写出下列物质的化学式:
试剂x________、试剂z________、晶体E________、固体G________.
(2)写出下列反应的离子方程式:
沉淀A+试剂y:___________;滤液D+过量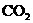 :_______________________
:_______________________
26、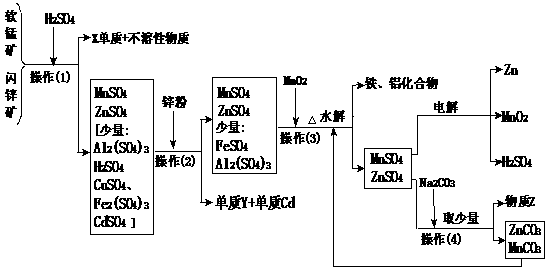 (10分)某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
(10分)某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
请回答:
(1)Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式:
____________________________________。
(5)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点: ____________________________________________。
25、(12分)过氧化氢(H202)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料。
(1)写出H202的电子式 ,
(2) H202与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H202反应生成酸式盐的化学方程式: 。
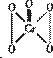 (3)在H202中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:
(3)在H202中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:
②这个反应是否是氧化还原反应? ,其理由是
(4)双氧水属于____(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________。
24、(10分)某学生为了测定某稀硫酸的物质的量浓度,用不同质量的纯锌粉与该硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
|
实验编号 |
加入锌粉的质量(g) |
稀硫酸的体积(mL) |
生成硫酸锌的质量(g) |
|
1 |
2.0 |
50.0 |
5.0 |
|
2 |
4.0 |
50.0 |
|
|
3 |
6.0 |
50.0 |
14.9 |
|
4 |
8.0 |
50.0 |
19.3 |
|
5 |
10.0 |
50.0 |
|
|
6 |
12.0 |
50.0 |
19.3 |
(1)第2、第5组两实验中生成硫酸锌的质量分别是 g和 g 。
(2)请在下图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉的质量[m(Zn)]的关系图(需要标明关键点的横坐标和纵坐标)。
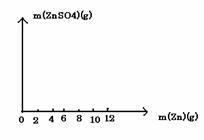 (3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为 g ;该稀硫酸的物质的量浓度为
mol/L。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为 g ;该稀硫酸的物质的量浓度为
mol/L。
23. (14分)某天然碱的化学组成可能为aNa2C03·bNaHC03·cH2O(a、b、c为正整数),为确定其组成,某同学作了如下探究:(1)定性分析
取少量天然碱样品放人试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
(2)定量分析
该同学设计了下图所示装置,测定天然碱的化学组成。

实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 ;A处碱石灰的作用是: 。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为87.6g,装碱石灰的U形管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓人空气数分钟。
④关闭活塞Kl、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞Kl,缓缓鼓人空气数分钟,然后称得装浓硫酸的洗气瓶的质量为88.5g;装碱石灰的U形管D的质量为75.8g。该步骤中鼓入空气时缓缓的目的是 。计算推导:该天然碱的化学式为 。
(3)讨论:有的同学认为:E装置是可以省略的,你的观点是 (“能”或“不能”)理由是: 。
22.(10分)研究性学习小组进行SO2的制备及性质探究实验。
(1) 根据反应Na2SO3(固) + H2SO4(浓) == Na2SO4 + SO2↑+H2O,制备SO2气体。
① 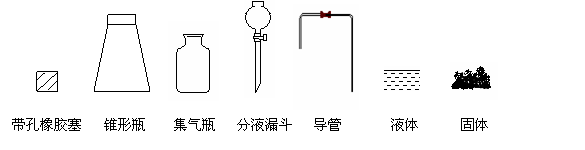 用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
② 实验过程中,使用分液漏斗滴加浓硫酸的操作是________________。
(2)将SO2气体分别通入下列溶液中:
①溴水溶液,现象是________________________________________。
②硫化钠溶液,现象是_____________________________________。
21. (4分)下列说法中,正确的是(填序号)_____________
A AgCl+NaBr=AgBr+NaCl能在水中进行,是因为AgBr比AgCl更难溶于水
B 用渗析法分离淀粉中混有的氯化银杂质 C 可以用分液漏斗将甘油和水的混合液体分离 D 用碱式滴定管量取20.00毫升高锰酸钾溶液
E 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F 在氢氧化铁胶体中加入少量硫酸会产生沉淀
G硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
20、设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.32g硫与足量铜完全反应转移的电子数为NA
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
08届高三化学第一次统测题
第II卷(非选择题,共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com