
题目列表(包括答案和解析)
25.(14分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国
家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”,
铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此作了报道,
血铅超标的病人正在接受有效治疗。
(1)82Pb在周期表的位置为 ,将SO2通入棕色PbO2的悬浊液会
产生白色PbSO4沉淀,写出PbO2与浓盐酸加热产生气体的离子方程式____________
_______________________________________________________________________。
(2)铅在自然界中主要以方铅矿(PbS)存在,铅锭冶炼厂主要采用火法冶炼铅,其主
要过程是先煅烧方铅矿制氧化铅(PbO),再用CO还原氧化铅。写出上述过程有关
的化学方程式 。
(3)铅蓄电池(又叫铅酸电池)是最常见的二次电池,它的两个极板上分别覆盖有PbO2
和Pb,放电过程中正极板上的反应为 ,电解质溶液的浓度将 (填“变大”、“变小”、“不变”),当外电路通过1mol电子时,理论上负极板的质量将_______(填“增加”或“减小”)_______g。
(4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的化学式_________________________,近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是 。
24.(8分)金属镁与镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一是以白云石(CaCO3·MgCO3)为原料,经高温煅烧生成氧化物(CaO·MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷凝为粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
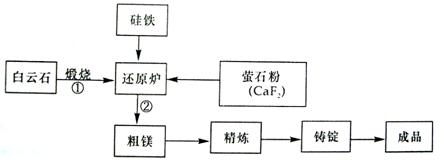
(1)若在实验室里煅烧白云石,可选择下列哪种坩埚?____________(填字母)
A.瓷坩埚 B.水晶坩埚 C.铁坩埚
(2)写出还原炉中硅铁还原氧化物的反应方程式
(3)在冶炼过程中反应温度对生成金属镁的影响如下图:
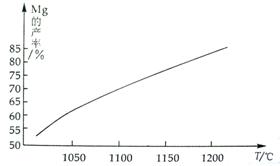
从图中可知,还原反应的反应热△H 0(填“>”、“<”),理由是
。
(4)还原炉中需要在1200℃真空条件下反应 ,反应达到平衡时的温度与压强的关系如下:
|
剩余压强/mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度/℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来说,可以达到的目的是
① ;②
23.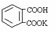 (10分)某学生用邻苯二甲酸氢钾
(相对分子质量为204.0)测定
(10分)某学生用邻苯二甲酸氢钾
(相对分子质量为204.0)测定
未知NaOH溶液的浓度,在本实验中达到滴定终点时,溶液的pH约为9.1。
(1)该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,在左盘上放一个1g
的砝码,调整游码平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为
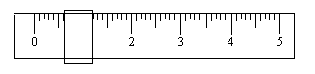 g。
g。
(2)将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴指示剂 (填“甲基橙”、“酚酞”或“石蕊”),当观察到
现象时,可停止滴定,记录数据。
(3)该学生进行了三次实验,所取固体均相同,所需未知氢氧化钠溶液的体积如下表:
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
18.2 |
|
2 |
19.7 |
|
3 |
19.5 |
根据上述数据,你认为该学生是否有必要再重复实验获取更多数据?原因是
。
(4)若不再重复实验,利用上述数据计算得到的NaOH溶液的物质的量浓度为
mol / L(准确到小数点后两位)。
(5)以下操作会造成NaOH溶液计算结果偏大的是 (填序号)
①未用氢氧化钠溶液洗涤碱式滴定管
②滴定前平视,滴定后俯视
③滴定前滴定管尖嘴有气泡,滴定后气泡消失
④滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶
22.(12分)氢氧化铜是一种常用试剂。例如,医院中使用含氢氧化铜浊液的仪器检测病人的尿液从而判断其病情。
Ⅰ、在实验室里模拟医院的测试
(1)选出以下操作正确的步骤,并按实验的先后顺序排列 ______(填写序号)
①取水浴后的少量溶液,加入新制备的Cu(OH)2悬浊液,加热3~5min,观察
②在洁净的试管中加入2mL2%的CuSO4溶液,再滴入4-6滴10%的NaOH溶液,充分振荡制得氢氧化铜悬浊液
③在洁净的试管中加入1mL20%的蔗糖溶液,加入3-5滴稀硫酸,水浴加热
④在洁净的试管中加入1mL20%的蔗糖溶液,加入新制备的Cu(OH)2悬浊液,加热3~5min
⑤在洁净的试管中加入2mL10%的NaOH溶液,再滴入2%的CuSO4溶液4-6滴,充分振荡制得氢氧化铜悬浊液
⑥取水浴后的少量溶液,加入氢氧化钠溶液调pH至碱性,再加入少量新制备的Cu(OH)2悬浊液,加热3~5min,观察
Ⅱ、下面是三个研究性学习小组分别从不同层面开展的研究性学习活动。
(2)甲小组对上述实验中生成的红色沉淀是Cu2O提出质疑,他们认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设。
假设一:
假设二:
假设三:
步骤二:查阅资料。已知:①+1价的铜在酸性条件下易发生自身氧化还原反应;②在空气中灼烧氧化亚铜生成氧化铜
步骤三:设计方案、实验
A.方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.方案3:取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,
再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.方案4:取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色
沉淀析出。
你认为合理的方案是(填字母) 。
(3)乙小组针对甲小组的质疑,设计新的探究方案,装置如下图,你认为要测定上述红
色沉淀成分必须测定下列哪些物理量(填序号) 。
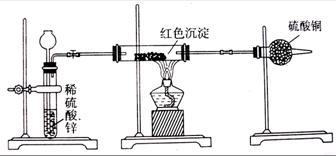
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
(4)丙小组从绿色化学的角度,打算“变废为宝”,收集上述红色沉淀制备化学试剂“胆矾”,请帮助他们完成一个简单且符合绿色化学要求的实验方案的设计,填写下列步骤内容。
① ;
② ;
③蒸发,浓缩结晶;
④ ;
⑤用滤纸吸干晶体表面的水分
21.(8分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及
印刷、纺织等工业。请根据要求回答下列问题:
(1)写出实验室制乙酸乙酯的化学方程式
(2) 欲提高乙酸的转化率,可采取的措施有 、 等
 (3)若用右图所示的装置来制备少量的乙酸乙酯,产率往往
(3)若用右图所示的装置来制备少量的乙酸乙酯,产率往往
偏低,其原因可能为: 、 等。
(4)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性
废液、催化剂重复使用困难等问题。目前对该反应的催
化剂进行了新的探索,初步表明质子酸离子液体可作此
反应的催化剂,且能重复使用。实验数据如下表所示
(乙酸和乙醇以等物质的量混合)
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
*选择性(%) |
反应时间/ h |
转化率(%) |
*选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.7 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
*选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件
A. 120℃,4h B. 80℃,2h C. 60℃,4h D. 40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能是____________________。
20. 高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)
高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+2H2(g)
CH3OH(g),若开始时只充入amolCH3OH蒸气,达到平衡时,混合物的压强比起始
时增大了70%;若开始时充入amolCO和2amolH2的混合气体,达到平衡时H2的转
化率为
A. 30% B. 35% C. 65% D. 70%
19.下列说法正确的是
A. 葡萄糖和果糖都是单糖,互为同分异构体;淀粉和纤维素都是多糖,却不是同分异构体
B. 在汽油中掺入一定比例的乙醇可得乙醇汽油,乙醇汽油是一种清洁能源
C. Na2O2、Al2O3和P2O5分别是碱性氧化物、两性氧化物和酸性氧化物
D. “海市蜃楼”既是一种自然现象又是光学现象,还与胶体的知识有关
18.下列实验能达到预期目的的是
A. 为减小配制溶液的误差,容量瓶必须洗净并烘干后才能使用
B. 向溶液中滴入盐酸有无色无味气体产生,则证明溶液中有CO32-
C. 含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
D. 把纯净的铁和锌用导线连接一起插入到经过少许酸化的3%的NaCl溶液中,往铁电极区滴入2滴铁氰化钾,可观察到蓝色沉淀
17.下列关于元素的叙述正确的是
A. 目前使用的元素周期表中,最长的周期含有36种元素
B. 只有在原子中,质子数才与核外电子数相等
C. 金属元素与非金属元素能形成共价化合物
D. 非金属元素形成的共价化合物中,原子的最外层电子数可能超过8
16.下列各溶液中,微粒浓度关系正确的是
A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是:
c(Cl-) > c(NH4+) > c(H+) > c(OH-)
B.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-) > c(Na+) > c(H+) > c(OH-)
C.0.1mol/L的Na2S溶液中:c(OH-) = c(H+) + c(HS-) + 2c(H2S)
D.1mol/L的KHCO3溶液中:c(K+) >c(HCO3-) > c(CO32-) > c(H+) > c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com