
题目列表(包括答案和解析)
1、“嫦娥一号”探月卫星的成功发射,是我国航天事业发展的又一里程碑。发射卫星的运载火箭的推进剂引燃后,会产生大量的高温气体从尾部喷出,该气体的主要成分是CO2、H2O、N2、NO等,在发射现场可以看到火箭尾部产生大量红色气体,你认为其原因最有可能的是( )
A.高温下N2遇空气生成了NO2 B.NO遇空气生成了NO2
C.CO2与NO反应生成了CO和NO2 D.NO与H2O反应生成了H2和NO2
23-A.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
 CH3COOH+C2H5OH
CH3COOH+C2H5OH 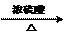 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,
且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
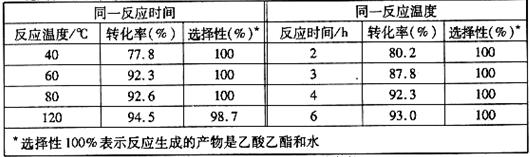
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
22.(13分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
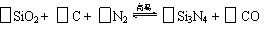
⑴配平上述反应的化学方程式(将化学计量数填在方框内)并用单线桥法表示电子转移的方向和数目;
⑵该反应的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热△H 零(填“>”、“<”或“=”;升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)= mol/(L·min)。
21.(7分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= kJ·mol-1;
⑵已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
20.(12分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。

请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_________(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________。
19.(8分)在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行 测定,测得如下数据:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
40.0 |
2.3 |
37.8 |
0.0 |
|
反应后质量/g |
43.6 |
待测数据 |
12.6 |
3.2 |
请回答下列问题:
(1)(4分)上表中“待测数据”的数值是多少_______,此密闭容器内发生的反应属于______________(填基本反应类型)。
(2)(4分)若X是水,Y是氮的氧化物,且反应式的计量系数比是n(X):n(Y):n(Z):n(Q)=2:4:4:1,则该反应的化学方程式为____________________________。
18.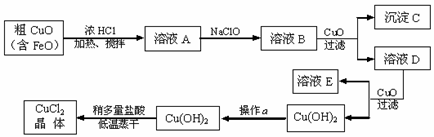 (8分)工业上制取CuCl2的生产流程如下:
(8分)工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
|
物
质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
⑴溶液A中加入NaClO的目的是 ;
⑵在溶液B中加入CuO的作用是 ;
⑶操作a的目的是 ;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2过程中,采取稍多量盐酸和低温蒸干措施的目的是 。
17.(14分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
⑴第①步制备粗硅的化学反应方程式为 。
⑵粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
⑶用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
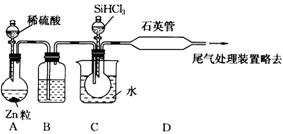
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
⑴第一份加入AgNO3溶液有沉淀产生
⑵第二份加足量NaOH溶液加热后,收集到气体0.04mol
⑶第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.Cl-可能存在 B.Ba2+一定不存在,Mg2+可能存在
C.K+一定存在 D.100mL溶液中含0.01mol CO32-
第Ⅱ卷(非选择题,共72分)
15. 一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是


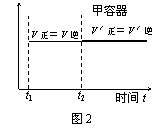




A.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
C.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
D.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com