
题目列表(包括答案和解析)
31、用沉淀法测定NaHCO3 和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
|
实验次数 |
样品质量/g |
沉淀质量/g |
|
1 |
1.716 |
2.758 |
|
2 |
2.574 |
|
|
3 |
3.432 |
5.516 |
|
4 |
4.290 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀的质量是
(2)Ba(OH)2溶液的物质的量浓度为____________
(3)第2次样品中含NaHCO3的物质的量为_____________
(4)取第2 次实验所得溶液体积的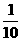 ,加水配制成500mL溶液,pH=
,加水配制成500mL溶液,pH=
30、利用芳香烃X和链烃Y可合成紫外线吸收剂BAD。BAD结构简式为:
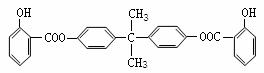
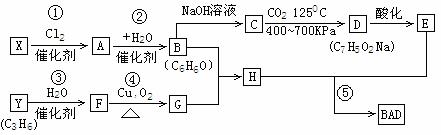
已知G不能发生银镜反应,BAD的合成路线如下:
试回答下列问题:
(1)写出结构简式:G_________,D_________。
(2)属于取代反应的有____________(填序号)
(3)1mol BAD最多可与含________mol NaOH的溶液完全反应。
(4)写出反应方程式:
反应④_______________________________________________
反应⑤_______________________________________________
29、A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少1个,已知: ①A中C、H、O的原子个数比为5:12:2, ②A不能发生消去反应,但能与C发生缩聚反应生成聚酯D,③B的水溶液呈酸性,分子中无甲基,一定条件下分子内可脱水生成环状有机物E。写出
(1)A、B、D的结构简式__________ ____________ ___________
(2)与B为同类物质但互为同分异构体的所有可能的结构简式
__________________________________________________________
28、你留意过标签上的化学吗?
(1)这是某品牌休闲西服标签上的部分内容:
|
等级:特级 成份:面料 羊毛80% 绦纶20% 里料 绦纶100% |
 |
|
熨烫标准:中温,不超过150℃ |
回答 ①其中属于合成纤维的是____________
②从此标签中可感觉羊毛、绦纶两种纤维的共同点有________。
③将面料、里料中各抽出一根来点燃,可观察到的现象是_______。
(2)某化肥厂生产的一种化肥,其包装袋上标有:
|
硝酸铵(NH4NO3) 净重 50kg 含氮量≥31.5% |
 |
①该厂生产的每一袋这种化肥中NH4NO3的质量应不少于_____kg。
②某些汽车的安全气囊中也装有NH4NO3,它在高温或猛烈撞击时,会迅速反应,产生大量气体,从而避免驾驶员受伤。其原理是:
2NH4NO3→2N2↑+O2↑+4H2O↑
③在使用此化肥时,你最想关照农民大哥的事情是 (至少说出两点)。
27、某化工厂生产皓矾(ZnSO4·7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu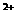 、Fe
、Fe 、Fe
、Fe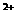 等杂质。已知0.01mol/L的Fe
等杂质。已知0.01mol/L的Fe 开始沉淀到完全沉淀的pH范围是2.7-3.7;ZnSO4饱和溶液(0.34mol/L)中Zn
开始沉淀到完全沉淀的pH范围是2.7-3.7;ZnSO4饱和溶液(0.34mol/L)中Zn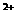 开始沉淀到完全沉淀的pH范围是5.7-8.0;当pH<5.7时,Na2CO3、ZnCO3发生酸解生成CO2。该厂除杂及生产的工艺流程如下图所示:
开始沉淀到完全沉淀的pH范围是5.7-8.0;当pH<5.7时,Na2CO3、ZnCO3发生酸解生成CO2。该厂除杂及生产的工艺流程如下图所示:
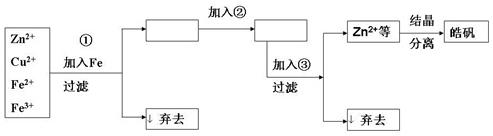
(1)加入的试剂②最好是 (填名称),其主要作用是 。
(2)为了调整溶液的pH,加入试剂③,供选用的试剂有NaOH、Na2CO3、ZnCO3、NH3·H2O、Ca(OH)2等,应当选用 ,理由是 。(3)从溶液中获得皓矾的操作依次是_______________________。
26、晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅;
②粗硅与干燥的HCl气体反应制得SiHCl3 (Si+3HCl→SiHCl3+H2)
③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃。
请回答:
(1)第一步制取粗硅的化学方程式___________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3可采用________的方法。
(3)实验室用SiHCl3与过量的H2反应制取纯硅的装置如图所示(加热器和夹持装置略去):
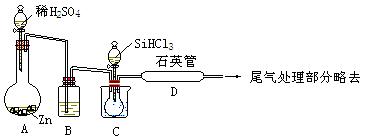
① 装置B中的试剂是________,装置C需水浴加热,目的是________。
② 反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是__________,D中发生的反应的化学方程式是________________________。
③ 为保证实验的成功,操作的关键除题中已告知的之外,你认为最重 要的还有: __________________________(说出三点)。
25、可逆反应Fe(s)+CO2(g)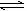 FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15
FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,在1173K时,K=2.15
(1)写出该反应的平衡常数表达式____________________
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件再达平衡后(选填“增大”、“减小”、“不变”)
①升高温度,CO2的平衡浓度__________,②再通入CO2,CO2的转化率___________, ③增大容器的体积,混和气体的平均分子量_________。
(3)该反应的逆速率随时间变化情况如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_______________(填序号,
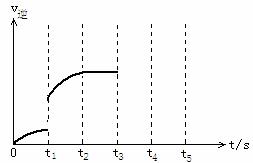 答案可能不止一个)
答案可能不止一个)
a. 升温 b. 增大CO2的浓度
c. 使用催化剂 d. 增压
②如果在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3~t5时间段的v逆变化曲线。
(4)能判断该反应达到平衡的依据是 。
A、容器内压强不变了 B、c(CO)不变了
C、v正(CO2)=v逆(CO ) D、c(CO2)=c(CO)
24、某主族元素R的单质可被稀HNO3氧化为R3+,R3+最外层有两个电子,在碱性条件下,R3+可被Cl2再氧化成带一个单位负电荷的含氧酸根离子,该阴离子在酸性条件下能将MnSO4溶液中的Mn2+氧化成高锰酸根离子,同时本身被还原成R3+。R元素与Cs元素同周期。写出R3+与Cl2反应、R的含氧酸根离子氧化MnSO4的离子方程式
(1)__________________________________________
(2)__________________________________________
标出反应(1)中电子转移的方向和总数,反应(2)可否用HCl酸化溶液__________(不可以的话要简述理由)?
23、下表是周期表的一部分
|
族 周期 |
I
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|
|
|
|
|
|
2 |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
|
3 |
|
|
⑧ |
|
|
⑨ |
⑩ |
以下填空都要用符号表示:
(1)由表中①⑥⑩三种元素形成的离子化合物的电子式___________,据说王水中含有由表中⑥⑦⑩三种元素组成的三原子分子的物质,该分子中所有原子都达到了稳定结构,试写出此种分子的电子式_____________。
(2)周期表中同一主族元素性质相似,但我们发现主族中左上方元素与右下方元素的性质也相似,如:③和⑧。写出③的氢氧化物与强碱溶液反应的离子方程式__________________________________;②的单质在空气中燃烧可能生成的物质的化学式_______________。
(3)表中原子⑧的电子排布式为_____________,原子④核外有_____个运动状态不同的电子,原子⑤核外有_______个未成对电子。
(4)俗称“矾”的一类物质通常含有的共同元素是表中的______。一般认为能构成物质种数最多的是表中的元素⑤,但也有人认为是表中的元素___。
22、在Fe2(SO4)3溶液中,加入ag Cu,完全溶解后,又加入bg Fe,充分反应后得到cg 残余固体,且a>c,则下列判断不正确的是( )
A、最后溶液中一定不含Fe3+ B、残余固体可能是Fe、Cu的混合物
C、最后溶液中一定含Fe2+ D、残余固体一定是Cu
第Ⅱ卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com