
题目列表(包括答案和解析)
4.NA表示阿伏加德罗常数,下列叙述中正确的是
A.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
B.标准状况下,11.2 L NO2和11.2 LN2O4的混合物所含的分子数为1.5 NA
C.2.0gD2O中所含中子数为0.1NA
D.常温常压下,22 g 氧气和26 g 臭氧所含氧原子总数为3 NA
3.2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
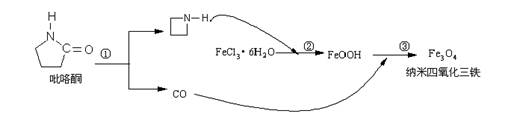
下列有关叙述不合理的是:
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
2.氡(22286Rn)可从矿泉水、岩石、地下水、天然气、建筑材料中释放出来。它可通过呼吸进入人体,停留在呼吸道中,放出α射线,其衰变产物还能放出β、γ射线。这些射线可诱发肺癌。关于氡的下列叙述正确的是
A.Rn的原子核内含有222个中子
B.Rn位于元素周期表中第6周期ⅧA族
C.Rn的化学性质不活泼,因此与任何物质都不能反应
D.新铺大理石地面的居室,可常打开门窗换气,以减少氡对人体的危害
1.背景材料:①2006年5月信息时报报道:世界卫生组织建议每天钠的摄取量少于2000mg,长期过量摄入钠可能引起高血压、肾病、胃病;②2006年初夏,四川大部分地区进行人工降雨;③空气是人类生存所必需的重要资源。改善空气质量称为“蓝天工程”;④2008年夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念。下列相应说法不正确的是
A.钠是活泼金属,常常保存在煤油中,人们每天可以摄取量少于2000mg的金属钠
B.AgI和干冰都可用于人工降雨
C.加大石油、煤炭的开采速度,增加化石燃料的供应量不利于“蓝天工程” 的建设
D. 把环境保护作为奥运设施规划和建设的首要条件之一
21.(B)[实验化学]
硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
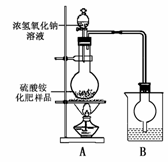
[实验探究]按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为: 烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是 。
[交流讨论] 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: 。
乙同学:实验装置中还存在另一个明显缺陷是: 。
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论] 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品。
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
21.(A)[物质结构与性质]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
a. 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
20.(10分) 乙烯是石油化工的重要原料,它主要通过石油产品裂解获得。
(1)石油产品裂解所得裂解气的平均组成可表示为CnHm(m>2n),经测定某裂解气中各气体的体积分数分别为:甲烷-4%、乙烯-50%、丙烯-10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到50 mol乙烯,x mol丁二烯和y mol氢气。则x+y= ,
n / m = (请用含x的式子表示)。
(2)某化工厂每天由石油产品裂解得到乙烯56吨。再以乙烯为主要原料生产醋酸乙烯酯,醋酸乙烯酯是合成维尼纶的重要单体。生产原理如下:
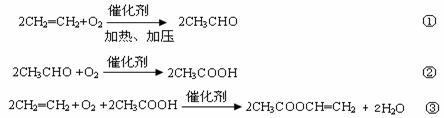
反应①中乙烯的利用率为80%,反应②中乙醛的利用率为83.33%,反应③中乙酸与乙烯的利用率均为85%。则该厂每天最多可制得醋酸乙烯酯多少吨?
18.(10分) 乙醇汽油是将乙醇和普通汽油按一定体积比混合而成,其密度与乙醇几乎相等,其中氧的质量分数为3.5%。请回答下列问题:
(1)乙醇汽油中乙醇的体积分数约为 。
(2)为减少氮的氧化物排放,将燃烧汽油的汽车改为以天然气为燃料电池的电动车,电池总反应为:CH4+2O2+2KOH==K2CO3+3H2O,则该电池的负极反应为 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4+4NO2 = 4NO+CO2+2H2O;CH4+4NO = 2N2+CO2+2H2O
若用标况下4.48 L CH4还原NO2至N2,整个过程中转移的电子数为 。
(4)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使汽车尾气中的酸性氧化物分解除去。转化流程如图所示:
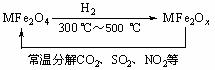
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
(5)请列举推广使用乙醇汽油的优点(至少回答两点): 。
17.(8分)Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。己知:
C (s) + H2O(g) 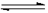 CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
(1)将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式 。
Ⅱ:在1 L的密闭容器中,进行反应到:CO2(g)+H2(g)
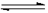 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
T(℃) |
700 |
800 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.7 |
2.6 |
(3) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.53 mol,若将混合气体加热至830℃,平衡时CO2的物质的量 (填“大于”、等于“”或“小于”)0.53 mol。
(4)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) 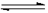 CO(g)+H2O(g)向 (填“正反应”或“逆反应”)方向进行,其的依据是 。
CO(g)+H2O(g)向 (填“正反应”或“逆反应”)方向进行,其的依据是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com