
题目列表(包括答案和解析)
3.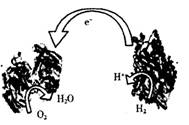 2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池。该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2 +O2=2H2O
,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图。下列说法不正确的是
2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池。该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2 +O2=2H2O
,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图。下列说法不正确的是
A. 右边电极为该电池的负极
B. 该电池可以在高温环境下使用
C. 该装置为化学能转变为电能的装置
D. 该电池正极发生的是还原反应
2. 下列各选项中,两个反应的化学原理最相似的是
A. 苯酚和丙烯都能使溴水褪色
B. 过氧化氢和二氧化硫都能使品红溶液褪色
C. 甲酸和甲醛分别与新制的氢氧化铜悬浊液共热,都产生红色沉淀
D. 明矾用于净水和氯气用于自来水的杀菌消毒
1. “绿色化学”是21世纪化学科学发展的重要方向之一,其核心是从源头上减少对环境的污染。你认为“绿色化学”是指化学工业生产中
A.对废气、废水、废渣进行严格处理
B.少用或不用有害物质以及少排或不排放有害物质
C.不使用任何化学物质
D.在化工厂种草、种树,使其成为花园式工厂
21A.物质结构与性质
A、B、C是原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2。请回答:
(1)C与A形成的最简单分子是 分子(填:“极性”或“非极性”),该分子再与A+元素结合成离子时,键角∠A-C-A发生改变,其原因是
。
(2)在由A、B两元素形成的一系列化合物中,若要求所有的原子都有可能在同一个平面中,则对B原子成键轨道的要求是:
(3)B元素在一定条件下可形成多种同素异形体,它们有的属原子晶体、有的属分子晶体、有的属混合型晶体,其中某种晶体的一个晶胞(如图1)中,含有 个B原子。原子晶体能否形成最密堆积结构,原因是
。
(4)D晶体的晶胞结构(如图2):若D原子的半径是r cm,则晶体D的密度是 。

21B.实验化学
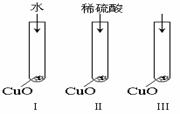
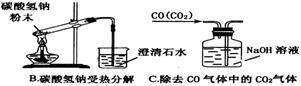
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如上右图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)某同学提出的假设是 。
(2)通过实验Ⅰ可以证明
。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入 ,再加入 。
(4)探究结果为 。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
08届高三化学上册第五次质量检测试题
20.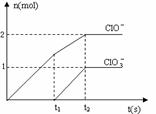 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后 2(填“>”、“<”或“=”);若
2(填“>”、“<”或“=”);若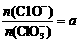 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
19.1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

⑴ 图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”) ;
⑵ 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
⑶ 过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
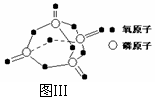 ⑷ 进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
⑷ 进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol–1 |
197 |
360 |
499 |
X |
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中X= 。
18.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
⑴钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为 。
⑵测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成V02+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
___VO2++____H2C2O4→___VO++___CO2+___H2O
其中还原剂是____;若反应消耗0.9g草酸,参加反应的钒元素质量是____g。
17.(10分)将A在密闭容器中加热得物质的量相等的B、C、D、E四种气体,若冷却容器到一定温度时,发现有晶体物质X生成,此时原4种气体中只有B没有参加反应,且在相同条件下B相对于氢气的密度为14,是有毒气体。有关物质的转化关系如下图,其中E在常温下为无色液体,G为淡黄色固体,X、F是一种常见的氮肥。反应①中n(C) :n(D)=2 :1,反应①②③④在工业生产中均有重要应用,图中部分反应条件及产物未注明。试回答下列问题:
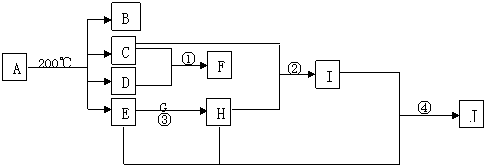
(1)A的化学式 F的化学式 C的结构式 G的电子式 。
(2)写出化学反应方程式
② ③ 。
(3)写出J的稀溶液与金属铜的离子反应方程式 。
16.(8分)某同一短周期元素的常见单质的沸点数据如右图所示。据此回答下列问题:
⑴单质D的分子式为 。与元素C
同主族的元素N和氢能构成18e-的分子,
其化学式为 。
⑵短周期元素M与元素A同主族,M的
最简单氢化物(R)1g完全燃烧生成液态水时,放出55.65 kJ的热量,则R的燃烧热为 kJ/mol,该反应的热化学方程式为 。
15.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有________________________。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是_______________________。



(3)下图为常见仪器的部分结构(有的仪器被放大)

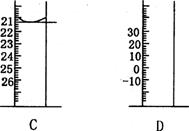
A图中液面所示溶液的体积为_____________mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是________(填字母标号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com