
题目列表(包括答案和解析)
(二) [猜想II]:主要成分为氯化锌;
[验证(操作)过程]:
;
[实验现象]:
;
[判断猜想]:猜想Ⅱ成立;
由上述实验得出的结论是:滤液中的主次成分:
.
23.(10分)钼(元素符号Mo)是银灰色的难熔金属,常见化合价为+6、+5、+4,常温下钼在空气中很稳定,高于600 ℃时很快地氧化生成三氧化钼(MoO3);
辉钼精矿(主要成分为MoS2)是生产钼的主要原料。制取过程包括氧化焙烧,三氧化钼、钼粉和致密钼的制取等主要步骤,工艺流程如图:


(1).辉钼精矿在600℃下进行氧化焙烧 转化为MoO3,同时产生SO2气体。主要反应的化学方程式为: 。钼冶炼厂对大气的污染主要来自于 ,你认为利用并处理该副产物的最好措施是 ;
(2)三氧化钼的制取
将焙砂(主要成分:MoO3)用氨水浸出,与氨水反应生成钼酸铵[(NH4)2MoO4]溶液:反应的离子方程式为: ;
该反应: (填是或不是)氧化还原反应。
将所得钼酸铵[(NH4)2MoO4]溶液加热到55-65 ℃,用盐酸调节至溶液的pH为2,搅拌析出多钼酸铵[(NH4)2O·mMoO3·nH2O]晶体;为除去钙、镁、钠等杂质,将多钼酸铵重新溶于氨水形成钼酸铵,使氨挥发后生成仲钼酸铵晶体[(NH4)2O·7MoO3·4H2O],将仲钼酸铵晶体脱水、煅烧得纯度为99.95%的三氧化钼(MoO3)。
(3)金属钼粉的生产:
工业上在管状电炉中用氢气分两步还原三氧化钼得到钼粉:
① 在450-650℃下: MoO3 + 3H2 === MoO2 + 3H2O
② 在900-950 ℃下:MoO2 + 2H2 === Mo + 2H2O
某同学根据上述还原原理,认为还可用 等还原剂还原MoO3得到钼粉。
(一) [猜想I]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]: (“填猜想I成立”或“填猜想I不成立”);
21.(10分) A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是最强的含氧酸之一。
(1). B在周期表中的位置:第 周期、第 族,E的元素符号为_______ ;
(2). 物质乙可用于潜艇或航天飞机作供氧剂,写出乙与CO2反应的化学方程式:
____________________________ ;
(3). 单质D与C的最高价氧化物对应水化物溶液反应的离子方程式:
______________________________________________________________________ ;
(4)1 mol 单质B的气体与1 mol C的氢氧化物在一定条件下恰好完全反应,生成一种盐、水及另一种气体,则所得气体的化学式为:__________________________ 。
22.(10分)某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
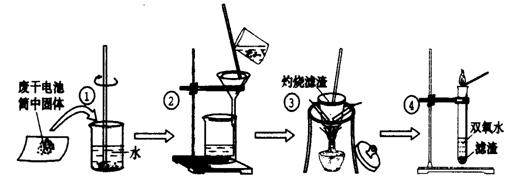
(1) 操作②中过滤时玻璃棒的作用: ;
(2) 操作④加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣含有MnO2,试管中发生反应的化学方程式: ;
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为: 。
(4) 已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
20.中科大陈乾旺教授等人发明RTX-r_合成金刚石的新方法,化学原理为:
① Na+CO2  C(金刚石)+C(石墨)+Na2CO3(未配平);
C(金刚石)+C(石墨)+Na2CO3(未配平);
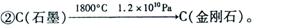 该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
以下表述中正确的是
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成12g金刚石需要消耗23g金属钠
D.反应①和反应②中所得的金刚石都是还原产物
19.常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/ c(H+)=1012 ,将这两种溶液等体积混合,以下离子浓度关系判断正确的是
A.c(H+)<c(OH-)<c(A-)<c(B+)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(A-)= c(B+)>c(H+)=c(OH-)
D.c(H+)+ c(B+)= c(OH-)+ c(A-)
18.下列离子方程式正确的是
A.用石墨作电极电解饱和食盐水:2Cl-+2H2O 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.Fe3O4与过量的稀HNO3反应: Fe3O4+8H+
 Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全: Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.Na2S溶液呈碱性:S2-+2H2O
 H2S+2OH-
H2S+2OH-
17.将1mol H2(g) 和2mol I2(g) 置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+
I2(g)  2HI(g) ;△H<0,并达到平衡,HI的体积
2HI(g) ;△H<0,并达到平衡,HI的体积
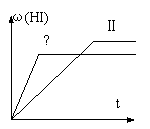
分数ω(HI)随时间变化如图(II)所示。若改变反应条件,
ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
A.恒温恒容条件下,加入适当催化剂 B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度 D.恒温条件下,扩大反应容器体积
16.设阿伏加德罗常数约为NA,下列叙述中正确的是
A.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数为NA
B.1 mol Fe在过量的 C12中充分燃烧,转移的电子数为2NA
C.0.1mol CH4所含的电子数为NA
D.1 L l mol·L-1的Na2C03溶液中离子总数为3NA
15.铜的冶炼大致可分为:
①.富集,将硫化物矿进行浮选;
②.焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2 FeO(炉渣);
③.制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2 ==2Cu2O+2SO2 ; 2Cu2O+ Cu2S==6 Cu+SO2↑;
④.电解精炼铜。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.上述过程中,由6mol CuFeS2制取6molCu时共消耗12 molO2
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连接
14. 由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是
A.已经制得了IBr、ICl等卤素互化物
B. 已经制得了I2O5等碘的氧化物
C. 已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子的离子化合物
D. 碘单质(I2)在通常情况下为具有金属光泽的紫黑色固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com