
题目列表(包括答案和解析)
4.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是:O2+4H++4e-=2H2O。下列叙述中不正确的是
A.电池的总反应是:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+
C.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入。
D.电池工作时,H+由正极移向负极
3.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子半径是短周期元素原子半径最大的。则下列叙述正确的是
A.由A和C形成的一种化合物与C和E形成的一种化合物能发生氧化还原反应
B.由A、C原子构成的分子和B、D原子构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
2.下列说法中错误的是
A.苯的硝化、碳酸钠晶体(Na2CO3·10H2O)的风化、铝的钝化等都是化学变化
B.煤的干馏、石油的分馏都是物理变化
C.甘油不是油,纯碱不是碱,干冰不是冰
D.水煤气、焦炉气、天然气都是混合物
1.化学与生活是紧密相联的,下列关于生活化学的说法正确的是
A.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
B.现在用的清洁燃料主要有两类:一类是压缩天然气,另一类为液化石油气,它们属于碳氢化合物
C.福尔马林是一种良好的杀毒剂,也可用来消毒自来水
D.保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
29.[物质结构与性质选做题] (10分).下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 (10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
(1)以上10种元素形成的单质中,与水反应最剧烈的金属是 (填写编号),
非金属性格最强的是 ;
 (2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为
、 。
(2)上述⑤、⑥、⑦三种元素中的两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质的化学式为
、 。
(3)某元素R的原子半径为1.02×10-10m,该元素是 ;其电子排布式为________________ ;
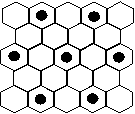
(4)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
28.[有机化学基础选做题] (10分)已知:
|
|






 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
已知:A的结构简式为:CH3-CH(OH)-CH2-COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
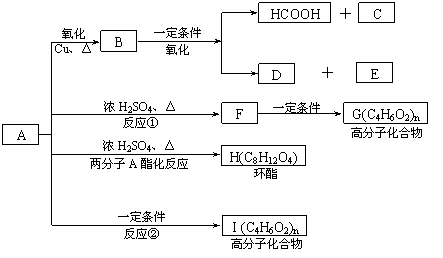
(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
27.(10分)氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
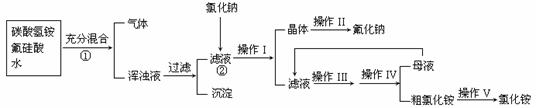
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:
(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式:② ;能够发生上述反应的原因: 。
(2)操作I和IV是相同的,请指出其名称 ;
(3)操作II中洗涤沉淀的过程是将漏斗中母液全部滤出后,
;
(4)流程①中NH4HCO3必须过量,其原因是 。
26.(10分)在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 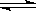 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)
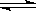 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2
(mol/L) |
H2
(mol/L) |
CO (mol/L) |
H2 O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
25.(10分)2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。如图表示两个丙烯分子进行烯烃换位,生成两个新的烯烃分子:2-丁烯和乙烯。

现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
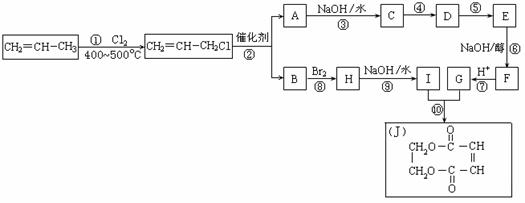
(1)反应①的类型:____________反应 ; G的结构简式:______________ ;
(2)反应②的化学方程式是___________________________________________ ;
(3)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是___________________________________,E的结构简式:_____________ ;
(4)反应⑨的化学方程式:___________________________________________ 。
24.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤: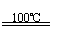
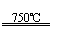
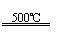
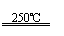 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
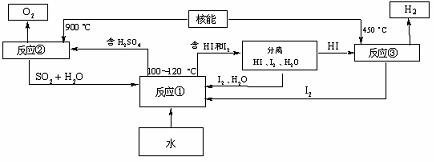
请写出反应①的化学方程式: ;
用法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com