
题目列表(包括答案和解析)
6.下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1,则氢气的燃烧热为285.8
kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH
溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol-1
D.己知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
5.水热法制备Fe3O4纳米颗粒的总反应为: ( )
3Fe2++2S2O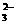 +O2+xOH-=Fe3O4+S4O
+O2+xOH-=Fe3O4+S4O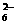 +2H2O
+2H2O
下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O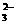 都是还原剂
都是还原剂
C.x=2 D.每生成1mol Fe3O4,则转移电子数为3mol
4.下列事实能用同一原理解释的是 ( )
A.SO2和Cl2都能用于漂白 B.苏打、小苏打水溶液的pH都大于7
C.苯酚、乙烯都能跟溴水反应 D.I2、NH4Cl晶体受热都逐渐消失
3.
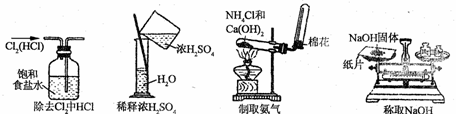 下列各图所示的实验原理、方法、装置和操作正确的是 ( )
下列各图所示的实验原理、方法、装置和操作正确的是 ( )
A B C D
2.下列叙述不正确的是 ( )
A.含硅的钢具有良好的导磁性
B.水晶和玛瑙的主要成分都是SiO2
C.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
D.太阳能电池可用硅材料制作,其应用有利于环保、节能
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”
活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是( )
A.加强工业用水系统的环保改造,提高水的重复利用率
B.加强城市生活污水处理,坚持达标排放
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.推广使用纯净水代替自来水作生活用水,以保障用水安全
26、(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g) ,根据题意完成下列各题:
CH3OH(g) ,根据题意完成下列各题:

(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
25、(15分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)写出该反应的离子方程式:
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
24、(20分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A
和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同
周期元素中原子半径最小。
(1)A2B分子的空间构型为 ,A2B和A2D的沸点较高者是 (填化学式),其原因是 ;
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有 ;
(3)E原子的电子排布式为: ;
B原子的轨道排布式为: ;
(4)写出C和E形成的化合物的电子式 ,该化合物在室温下属 晶体,每
个C紧邻 个E.已知 C和E形成的化合物的摩尔质量为Mg.mol-1,晶体中紧邻的C
和E距离为为a cm,计算该晶体的密度为 g.cm-3(阿佛加德罗常数用NA
表示).
23、(5分)同温同压下,相同体积的CO和CO2相比较,
(1)它们所含的分子数目之比为:
(2)它们所含的O原子数目之比为:
(3)它们所含的C原子数目之比为:
(4)它们所含的原子总数目之比为:
(5)它们所含的电子数目之比为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com