
题目列表(包括答案和解析)
4.下列对有关化学反应过程或实验现象的解释中,正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
3.用右图表示的一些物质或概念间的从属关系中不正确的是
|
|
X |
Y |
 Z Z |
|
例 |
氧化物 |
化合物 |
纯净物 |
|
A |
苯的同系物 |
芳香烃 |
芳香族化合物 |
|
B |
胶体 |
分散系 |
混合物 |
|
C |
碱性氧化物 |
金属氧化物 |
氧化物 |
|
D |
电解质 |
离子化合物 |
化合物 |
2.氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为 
B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价
C.Na2O2的电子式为Na+ Na+
Na+
D.在MgO晶体中,O2-的电子排布式可表示为 1s22s22p6
1.“显微学的新前沿”被列为美国科学杂志2006年度十大科技进展之一。生物学家借助新的显微技术,成功观察到小于200纳米的细节。下列分散系中,分散质微粒半径最小的是
A.雾 B.蛋白质溶液
C.NaCl溶液 D.新制氢氧化铜悬浊液
23.(10分) 标况下,在100 mL0.1mol·L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示。(假设生成的CO2全部逸出)。
求:
(1)该稀盐酸物质的量浓度c(HCl)。
(2)滴加稀盐酸至50mL时共产生气体体积。
(3)滴加盐酸前溶液中所含溶质的成分及各自的物质的量浓度。
22.(8分)目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成(说明:Mg(OH)2在高温下分解为MgO)。现按如下步骤测定药剂中三种主要成分的配比:
①取药剂样品,研磨后,加入50mL3.6 mol·L-1盐酸,正好完全反应并收集得到标准状况下224mL气体
②过滤,弃去其中不溶性物质(其余成分不参与反应)
③取②中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
试求该药剂中三种主要成分的物质的量之比。
21. (10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
(10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
(1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为_____________________________________________________
__________________________________________________________。
(2)写出电解E水溶液的化学方程式__________________________________________。
(3)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
19.(10分)大城市机动车带来的污染问题不容忽视。汽车排出尾气中含有CO、NOx和其他大气污染物,其成分与车速有关。下面是不同车速时排放的污染物质量(以平均行驶1km算);
|
车速(km/h) |
CO/g |
NOx/g |
碳氢化合物/g |
|
50 |
8.7 |
0.6 |
0.6 |
|
80 |
5.4 |
1.5 |
0.7 |
|
120 |
9.6 |
3.8 |
0.8 |
(1)随着汽车速度增加,污染气体排放量随之增加最多的是 。
(2)在汽车尾气系统中装置催化转化器,可使尾气中的CO和NOx在催化剂作用下相互发生氧化还原反应转化成两种无毒的气体,从而有效减少尾气中大气污染物。
该反应的化学方程式为 。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数
(4)随着我国家用汽车数量的迅猛增加,不但中速了城市空气污染,而且加剧了能源危机,导致石油和石油产品的价格不断攀升。往汽油中混入比例达到20%至35%的酒精,不仅可以节约汽油,而且可以减少70%以上的污染。已知酒精的燃烧热为1367kJ,请写出酒精燃烧的热化学方程式:
。
18.(10分)莫尔盐[(NH4)2SO4·FeSO4·6H2O]在
空气中比一般亚铁盐稳定,是化学分析中常用
的还原剂。某研究性学习小组用右图所示的实
验装置来制取莫尔盐,实验步骤如下:
①用30%的NaOH溶液和废铁屑混合、煮沸、
冷却、分离,将分离出的NaOH溶液装入F中;
②在E中用①处理过的铁屑和稀H2SO4反应制取FeSO4;
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合,结晶得到莫尔盐。
试回答下列问题:
(1)利用铁屑和稀硫酸反应产生的氢气赶走装置中的氧气及硫酸铵溶液中溶解的氧,其目的是_________________________________;铁屑和稀硫酸反应产生的氢气的另外一个作用是_______________________________________________。
(2)如何设计一个简单的实验证明得到的产品中有Fe2+?
______________________________________________________________________
____________________________________________________________________。
(3)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。若取产品24.50g配成100mL溶液,取出10mL用0.10mol·L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL。
①试配平反应的离子方程式:
______MnO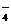 +_____Fe2++_____H+=_____Fe3++______Mn2++______H2O
+_____Fe2++_____H+=_____Fe3++______Mn2++______H2O
②试求产品中莫尔盐的质量分数_______________ (NH4)2SO4·FeSO4·6H2O的相对分子质量为392)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com