
题目列表(包括答案和解析)
21.(8分) (1)室温下,pH=2的硫酸氢钠溶液中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+) 0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = mol·L-1
c(H+) - c(MOH) = mol·L-1
20.(10分)钨是我国丰产元素。自然界钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:

⑴已知上述转化中W的化合价未发生变化,则产品C的化学式 ;如何将其冶炼成单质(用化学方程式表示) 。根据金属的活动性不同,金属的冶炼方法一般有 三种。
⑵写出第一步转化中“Mn2+→MnO2”的离子方程式 。
⑶我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。已知x的值0.1,则蓝色氧化钨中这两种价态的钨原子数之比为 。
19. (10分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:

请回答:
(1)写出C元素的原子结构示意图__ ___,戊的电子式________;
(2)用有关化学用语解释:丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①甲溶液+乙溶液(足量)→己溶液________;②乙溶液+丙溶液→丁____________。
18.(16分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
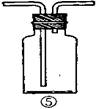

⑴请根据甲同学的意图,连接相应的装置,接口顺序:
b接 接a。
⑵U形管中所盛试剂的化学式为 。
⑶装置③中CCl4的作用是 。
⑷乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在
之间(填装置序号)。瓶中可以放入 。
⑸丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到 的现象,则证明制Cl2时有HCl挥发出来。
17.(4分)下列有关实验的叙述中,合理的是 ( 多选倒扣分)
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚烧氢氧化钠或碳酸钠
C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
D.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.测定胆矾结晶水含量时,加热后无水硫酸铜粉末表面发黑,会使测定结果偏高
G.为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液
H.中和热测定实验,用铜质搅拌棒代替环形玻璃搅拌棒,所测得的中和热数值偏高
G.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
I. 用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液
16.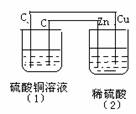 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后测得导线上通过了0.02mole-。若不考虑溶液体积变化,下列叙述正确的是
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后测得导线上通过了0.02mole-。若不考虑溶液体积变化,下列叙述正确的是
A.相同条件下,两容器产生的气体体积不相同
B.(1)、(2)溶液的pH值均减小
C.(1)中阳极电极反应方程式为:4OH--4e-=2H2O+O2↑
D.(2)中负极析出0.02g H2
第Ⅱ卷(非选择题 共72分)
15.已知(1)胆矾失水反应的热化学方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l); △H=+Q1kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)=Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
(3)胆矾溶于水时,溶液温度降低。
则Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
14. A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热保持恒压的气球。关闭K2,将少量且等量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
[已知:2NO2(红棕色)  N2O4(无色) ; △H<0 ] 下列说法正确的是
N2O4(无色) ; △H<0 ] 下列说法正确的是
A.一段时间后反应达到平衡,此时A、B中生成N2O4速率是v(A)> v(B)
B.若打开活塞K2,气球B将变大
C.如果将已开启的K2关闭,再向A、B中分别充入与初始量相等的NO2,则达到新平衡时,A中NO2的转化率将增大
D.保持K2关闭、室温和A、B体积都不变,将A套上一个绝热层,B与外界可以进行热传递,向真空的A、B中分别充入等量且少量的NO2,达到平衡时混合气颜色较深的是容器A
13.下列说法不正确的是
A.离子化合物一定是强电解质,共价化合物一定是弱电解质
B.电解质溶液的导电过程就是电解的过程
C.处于平衡状态的可逆反应中,若平衡向正反应方向移动,逆反应速率一定减小
D.正盐的水溶液呈酸碱性是由于水的电离平衡被破坏所造成的
12.下列离子反应方程式书写正确的是
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.铜片加入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C.1L2mol/L的FeBr2溶液中通入2.5molCl2:2Fe2++4Br-+3Cl2=6Cl-+2Fe3++2Br2
D.四氧化三铁粉末溶于足量的稀HNO3:Fe3O4+8H+=2Fe2++Fe3++4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com