
题目列表(包括答案和解析)
7.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的 原理为
①2MoS2+7O2 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl;
④H2MoO4 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排空
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3︰3︰2
6.下列除去杂质的实验方法正确的是( )
①除去K2CO3固体中少量NaHCO3:置于坩埚中加热
②除去苯中溶有的少量苯酚:加入稍过量浓溴水反应过滤
③除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
④用过量氨水除去Al3+溶液中的少量Fe3+
⑤将混合气体通过灼热的铜网除去N2中少量O2
⑥用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
⑦用盐酸除去AgCl中少量的Ag2CO3
⑧除去CO中少量O2:通过灼热的Cu网后收集气体
A.②③⑤⑥ B.①③④⑤⑧ C.③⑤⑥⑦ D.②③⑥
5.下列有关实验操作或判断正确的有( )
①用10 mL量筒准确量取稀硫酸溶液8.0 mL;
②用干燥的pH试纸测定氯水的pH;
③能说明亚硝酸是弱电解质的是:用HNO2溶液作导电试验,灯泡很暗
④使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大;
⑤将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体;
⑥圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
⑦除去铁粉中混有的少量铝粉.可加人过量的氢氧化钠溶液,完全反应后过滤
⑧为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
⑨用食醋除去水壶中的水垢
A.3个 B.4 个 C.5个 D.6个
4.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是( )
A  B
B  C
C 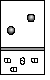 D
D 
3.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5mol/L的HCl溶液中和,则生成物的成分是( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
2.下列叙述正确的是( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、氯化钠晶体分散到酒精中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦按照纯净物、混合物、强弱电解质和非电解质顺序排列的是.单甘油酯、混甘油酯、苛性钾、次氯酸、氯气
⑧金属元素和非金属元素形成的化合物一定是离子化合物
A.①②③④ B.②③⑥ C.①③④⑤⑥⑦⑧ D.②④⑦
1.下列叙述正确的是( )
①A r原子的结构示意图为
②Fe、Cu的价电子排布式分别为:3d64s2 3d104s1
③Al、N原子结构中单电子数分别为:1、3
④SiO2、NaCl、S、He不能代表一个分子,不是分子式,而CO2、C60代表一个分子,是分子式
⑤在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
⑥乙烯的结构简式为:CH2CH2 甲烷的最简式为:CH4
⑦21H2、11H2互为同位素,其摩尔质量分别为:4、2
⑧由两种原子组成的纯净物一定是化合物
⑨聚乙烯有固定沸点
⑩能证明氯化氢是共价化合物的是:氯化氢不易分解
A.①②③ B.①②③⑤⑦ C.①③④⑥⑦⑧⑨ D.①⑤⑦⑩
24.(8分)工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下: C+O2 CO2 ① CaCO3
CO2 ① CaCO3 CO2↑+CaO ②
CO2↑+CaO ②
⑴纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是
。
⑵纯净的CaCO3和焦炭按①②完全反应,当窑内配比率
 =2.20时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1。计算结果保留3位有效数字。下同)
=2.20时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1。计算结果保留3位有效数字。下同)
⑶某次窑气成分(按体积分数计)如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
23.(6分)某石墨回收厂,为将回收的石墨棒处理成疏松状的碳粉,采用浓硫酸蒸煮废石墨棒的落后生产工艺,这种落后工艺所造成的恶劣后果是排入水体的废酸液导致严重环境污染。试完成下列问题:
⑴写出用浓硫酸蒸煮石墨发生的化学方程式。这种方法除废酸污染水体外,还将对大气有什么危害?。
⑵ 该厂每天向附近溪水中排放400吨废酸液,某环保组测得该溪水中污染指数如下:
|
pH值 |
水中悬浮物(mg/L) |
氟化物(mg/L) |
化学需氧量(CODmg/L) |
|
1.8 |
7143 |
3100 |
2670 |
以上数据表明氟化物是国家规定允许排放标准的310倍,COD是国家规定允许排放标准260倍。为净化这条溪水,除责令该厂停产整顿外,主管部门决定,建在这条溪水上游的某水库开闸放水以稀释污染物。请计算上游水库排放的流量应为每秒多少立方米时才能使该溪水中氟化物、COD指标达到国家规定允许排放标准? (设废酸液密度为1 g/cm3,计算结果精确到0.01)
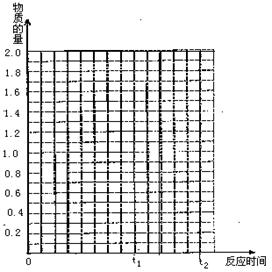
22. (10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g),△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
⑴反应进行到t1时,SO2的体积分数为 。
⑵若在t1时充入一定量的氩气(Ar),SO2的物 质的量将 (填“增大”、“减小”或“不变”)。
⑶若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),并简单说明原因 .
⑷若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,在图中作从t0→t1→t2这段时间内SO2的物质的量变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com